50 Beispiele für Säuren und Basen

- 1371
- 42
- Nick Laurén
Es gibt hunderte Beispiele für Säuren und Basen Dies ist in allen Zweigen der Chemie zu finden, aber insgesamt sind sie in zwei große Familien unterteilt: anorganische und organische. Anorganinsäuren werden normalerweise als Mineralsäuren bezeichnet, die durch besonders starke im Vergleich zu organischer Kennzeichnung gekennzeichnet sind.
Säuren und Basen werden als Substanzen verstanden, die landwirtschaftliche Aromen bzw. Saponáceos haben. Beide sind ätzend, obwohl das Wort "ätzend" normalerweise für starke Basen verwendet wird. In summarischen Berichten: Sie verbrennen und laufen die Haut, wenn sie sie berühren. Seine Eigenschaften in Lösungsmittelmedien haben im Laufe der Geschichte eine Reihe von Definitionen geplant.
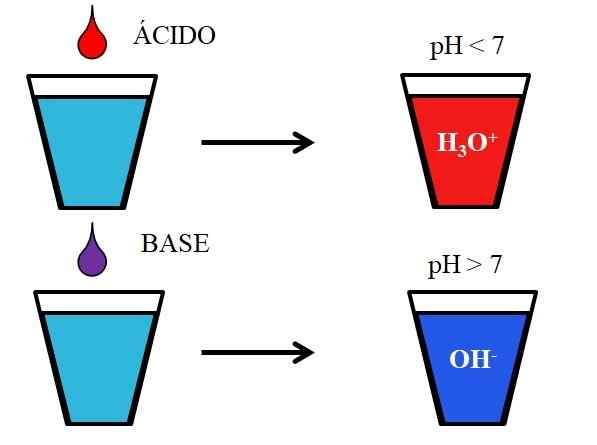 Verhalten von Säuren und Basen, wenn es in Wasser gelöst ist. Quelle: Gabriel Bolívar.
Verhalten von Säuren und Basen, wenn es in Wasser gelöst ist. Quelle: Gabriel Bolívar. Das untere Bild zeigt das generische Verhalten von Säuren und Basen, wenn sie zugegeben oder in einem Glas mit Wasser gelöst werden. Säuren produzieren Lösungen mit pH -Werten unter 7 aufgrund von Hydronios -Ionen, H3ENTWEDER+; Während die Basen aufgrund von Hydroxylionen (oder Oxydril) Lösungen mit einem pH über 7 produzieren, OH-.
Wenn wir Salzsäure, HCl (roter Tropfen), dem Glas hinzufügen, wird es H -Ionen geben3ENTWEDER+ und Cl- hydratisiert. Auf der anderen Seite haben wir, wenn wir das Experiment mit Natriumhydroxid, Naoh (lila Tropfen), OH -Ionen haben- und na+.
[TOC]
Definitionen

Die zunehmend untersuchten und verstandenen Eigenschaften von Säuren und Basen setzen mehr als eine Definition für diese chemischen Verbindungen. Unter diesen Definitionen haben wir die von Arrhenius, die von Bronsted-Lowry und schließlich die von Lewis. Bevor Sie die Beispiele zitieren.
Arrhenius
Säuren und Basen sind laut Arrhenius diejenigen, die in Wasser aufgelöst wurden3ENTWEDER+ oder oh-, bzw. Das heißt, das Bild repräsentiert diese Definition bereits. Allerdings verachtet es einige zu schwache Säuren oder Basen, um solche Ionen zu produzieren. Hier tritt die Definition von Bronsted-Lowry ein.
Kann Ihnen dienen: Säuren: Eigenschaften und BeispieleBronsted-Lowry
Bronsted-Lowry-Säuren sind diejenigen, die Ionen h spenden können+, Und die Basen sind diejenigen, die diese h akzeptieren h+. Wenn eine Säure sehr leicht spendet+, Es bedeutet, dass es eine starke Säure ist. Gleiches gilt für die Basen, aber haupt H+.
Somit haben wir starke oder schwache Säuren und Basen, und ihre Kräfte werden in verschiedenen Lösungsmitteln gemessen; insbesondere im Wasser, von dem die bekannten pH -Einheiten hergestellt werden (von 0 bis 14).
Daher wird eine starke Säure ihre H vollständig spenden+ zum Wasser in einer Reaktion des Typs:
Ha + h2O => a- + H3ENTWEDER+
Wohin- Es ist die konjugierte Basis von HA. Von hier kommt also der h3ENTWEDER+ im Glas mit sauren Lösung vorhanden.
In der Zwischenzeit wird eine schwache B -Basis das Wasser ungeschützt, um ihren jeweiligen H zu gewinnen+:
B + h2Oder HB + OH-
Wobei HB die konjugierte Säure von B ist. Dies ist der Fall von Ammoniak, NH3:
NH3 + H2Oder NH4+ + Oh-
Eine sehr starke Basis kann direkt OH -Ionen spenden- Keine Notwendigkeit, mit Wasser zu reagieren; Wie beim Naoh.
Lewis
Schließlich sind Lewis -Säuren diejenigen, die Elektronen gewinnen oder akzeptieren, und Lewis 'Stützpunkte sind solche, die Elektronen spenden oder verlieren.
Zum Beispiel die Bronsted-Lowry NH-Basis3 Es ist auch eine Lewis -Basis, da das Stickstoffatom ein h akzeptiert+ Indem Sie dies ihre kostenlosen Elektronen spenden (h)3N: h+). Aus diesem Grund stimmen die drei Definitionen nicht miteinander nicht ein.
Kann Ihnen dienen: Nickel: Geschichte, Eigenschaften, Struktur, Verwendungen, RisikenBeispiele für Säuren
Nach der Klärung der Definitionen wird eine Reihe von Säuren nachstehend mit ihren jeweiligen Formeln und Namen erwähnt:
-HF: Fluorhydsäure
-HBR: Bromhydsäure
-Hi: Yodhydriksäure
-H2S: Sulfhydsäure
-H2SE: seleenhydrische Säure
-H2TE: Telurhydricsäure
Dies sind Binärsäuren, auch Hydrrazeids genannt, die zur oben genannten Salzsäure HCl gehört.
-Hno3: Salpetersäure
-Hno2: Salpetersäure
-Hno: Hyponitrous Säure
-H2CO3: Kohlensäure
-H2CO2: Carbonosäure, die tatsächlich eher unter dem Namen Foricsäure, HCOOH, der einfachsten organischen Säure von allen bekannt ist
-H3Po4: Phosphorsäure
-H3Po3 oder h2[HPO3]: Phosphorsäure mit einer H-P-Bindung
-H3Po2 oder h [h2Po2]: Hypophosphärzäure mit zwei H-P-Bindungen
-H2SW4: Schwefelsäure
-H2SW3: Schwefelsäure
-H2S2ENTWEDER7: Disulfursäure
-HIO4: Periódinsäure
-HIO3: Yodiumsäure
-HIO2: Iodosesäure
-HIO: Hypoyodossäure
-H2Cro4: Chromsäure
-Hmno4: Mangansäure
-CH3COOH: Essigsäure (Essig)
-CH3SW3H: Metanosulfonsäure
Alle diese Säuren mit Ausnahme der Formic und den letzten beiden sind als Oxácidos oder ternäre Säuren bekannt.
Andere:
-Alcl3: Aluminiumchlorid
-Fecl3: Eisenchlorid
-Bf3: Boro Trifluoruro
-Metallkationen in Wasser aufgelöst
-Karobokationen
-H (CHBelfClelf): Super Säure Carborano
- Fso3H: Fluorosulfonsäure
- Hsbf6: Fluorantimonsäure
- Fso3H · SBF5: Magie Säure
Die letzten vier Beispiele bilden die furchterregenden Supersäuren; Verbindungen, die in der Lage sind, fast jedes Material mit kaum berührtem Auflösen auflösen zu können. Die Alcl3 Es ist ein Beispiel für Lewis -Säure, da das Aluminium -Metallzentrum aufgrund seines elektronischen Mangels Elektronen akzeptieren kann (es vervollständigt nicht das Valencia -Oktett).
Kann Ihnen dienen: Quecksilberhydroxid: Struktur, Eigenschaften, Verwendungen, RisikenBeispiele für Basen
Unter den anorganischen Basen haben wir Metallhydroxide wie Natriumhydroxid und einige molekulare Hydurns wie bereits zitiertes Ammoniak. Hier sind weitere Beispiele für Basen:
-Koh: Kaliumhydroxid
-Lioh: Lithiumhydroxid
-RBOH: Rubidio Hydroxid
-CSOH: Cäsiumhydroxid
-Froh: Francio Hydroxid
-Sein (oh)2: Beryl Hydroxid
-Mg (OH)2: Magnesiumhydroxid
-CA (OH)2: Kalziumhydroxid
-SR (OH)2: Strontiumhydroxid
-Ba (oh)2: Bariumhydroxid
-Ra (oh)2: Radiohydroxid
-Glaube (OH)2: Eisenhydroxid
-Glaube (OH)3: Eisenhydroxid
-Al (OH)3: Aluminiumhydroxid
-PB (OH)4: Plúmbic Hydroxid
-Zn (OH)2: Zinkhydroxid
-CD (OH)2: Cadmiumhydroxid
-Cu (OH)2: Cupric Hydroxid
-Ti (OH)4: Titanic Hydroxid
-PH3: Phosphin
-Asche3: Arsina
-Nanh2: Natriummasturo
- C5H5N: Pyridin
-(CH3) N: Trimethylamin
- C6H5NH2: Phenylamin oder Anilin
-Nah: Natriumhydrid
-KH: Kaliumhydrid
-Karbanionen
-Li3N: Lithiumnitrid
-Alcoxides
-[(CH3)2CH]2NLI: Diisopropilamid von Lithium
-Diätinilbenzol -Anion: C6H4C42- (die bisher bekannte Basis)
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Naomi Hennah. (10. Oktober 2018). Wie man Säuren, Basen und Salze lehrt. Erholt von: edu.RSC.Org
- Helmestine, Anne Marie, ph.D. (31. August 2019). Formeln von gemeinsamen Säuren und Basen. Erholt von: thoughtco.com
- David Wood. (2019). Vergleich gemeinsamer Säuren und Basen. Lernen. Erholt von: Studium.com
- Ross Pomeroy. (23. August 2013). Die stärksten Säuren der Welt: wie Feuer und Eis. Erholt von: RealClearScience.com
- Wikipedia. (2019). Diethynylbenzol Dianion. Abgerufen von: in.Wikipedia.Org
- « Durchmesser von Durchmesser und Formeln, wie man es herausnimmt, Umfang
- Ökophysiologie Welche Studien und Anwendungen bei Tieren und Gemüse »

