Absorption Was ist, Beispiele und Übungen gelöst
- 659
- 99
- Lewis Holzner
Der Absorption Es ist der Logarithmus mit einem negativen Vorzeichen des Quotienten zwischen der aufkommenden Lichtintensität und der Lichtintensität der Lichtfälle auf einer Probe von durchscheinender Lösung, die mit monochromatischem Licht beleuchtet wurde. Dieser Quotient ist der Durchlässigkeit.
Der physische Prozess des Lichts durch eine Probe wird genannt leuchtendes Getriebe, Und Absorption ist ein Maß dafür. Daher wird die Absorption zum geringsten Logarithmus der Sendung und ist eine wichtige Tatsache, um die Konzentration einer Probe zu bestimmen, die im Allgemeinen in einem Lösungsmittel wie Wasser, Alkohol oder anderen gelöst ist.
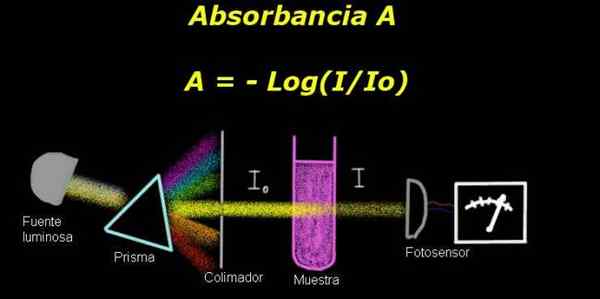
 Abbildung 1. Schema des Absorptionsprozesses. Vorbereitet durch f. Zapata
Abbildung 1. Schema des Absorptionsprozesses. Vorbereitet durch f. Zapata Um die Absorption zu messen, ist ein Gerät erforderlich Elektro-Photometer, mit dem ein Strom gemessen wird, der proportional zur leuchtenden Intensität ist, die auf seiner Oberfläche fällt.
Bei der Berechnung der Durchlässigkeit wird das Signal der dem Lösungsmittel allein entsprechenden Intensität im Allgemeinen gemessen und dieses Ergebnis wird als aufgezeichnet Io.
Dann wird die im Lösungsmittel gelöste Probe mit denselben Beleuchtungsbedingungen platziert. Die vom Elektro-Photometer gemessene Maßnahme wird als bezeichnet als Yo, Dadurch können Sie die Durchlässigkeit berechnen T Nach der folgenden Formel:
T = i / ientweder
Es ist eine entfesselte Menge. Der Absorption a Dies wird ausgedrückt als:
A = - log (t) = - log (i / ientweder)
[TOC]
Molare Absorption und Absorption
Die Moleküle, aus denen eine Chemikalie besteht. Es ist das Ergebnis der Wechselwirkung zwischen Photonen und molekularen Elektronen.
Daher ist es eine Größe, die von der Dichte oder Konzentration der Moleküle abhängt, aus denen die Probe besteht.
Sie können Ihnen dienen: Newtons drittes Gesetz: Bewerbungen, Experimente und ÜbungenExperimentelle Daten zeigen diese Absorption an ZU ist linear proportional zur Konzentration C und Entfernung D Licht reiste. Um es basierend auf diesen Parametern zu berechnen, kann die folgende Formel festgelegt werden:
A = εoge
In der vorherigen Formel, ε Es ist eine Konstante der Verhältnismäßigkeit, die unter dem Namen von bekannt ist Molar absorbierend.
Die molare Absorption hängt von der Art von Substanz und Wellenlänge ab, mit der die Absorption gemessen wird. Der Molar absorbierend Es ist auch empfindlich gegenüber der Temperatur der Probe und des pH -Werts desselben.
Bier-Lambert-Gesetz
Diese Beziehung zwischen Absorption, Absorption, Konzentration und Abstand von der Dicke des Weges, dem das Licht innerhalb der Probe folgt, wird als Beer-Lambert-Gesetz bezeichnet.
 Figur 2. Biergesetz - Lambert. Quelle: f. Zapata,
Figur 2. Biergesetz - Lambert. Quelle: f. Zapata, Unten finden Sie einige Beispiele für die Verwendung.
Beispiele
Beispiel 1
Während eines Experiments eine Probe mit einem roten Licht eines Helium-Neon-Laserlichters, dessen Wellenlänge 633 nm beträgt. Ein Elektrofotometer misst 30 mV, wenn sich Laserlicht direkt auswirkt, und 10 mV, wenn es durch eine Probe geht.
In diesem Fall ist die Durchlässigkeit:
T = i / io = 10 mV / 30 mV = ⅓.
Und die Absorption ist:
A = - log (⅓) = log (3) = 0,48
Beispiel 2
Wenn die gleiche Substanz in Behälter gelegt wird, der die Hälfte der dicken hat.
Es muss berücksichtigt werden, dass die Absorption, die proportional zur optischen Dicke ist, um die Hälfte abnimmt, wenn die Dicke auf die Hälfte abnimmt, dh a = 0,28, dh a = 0,28. Tonnenübertragung werden durch die folgende Beziehung angegeben:
Kann Ihnen dienen: Vertikaler Schuss: Formeln, Gleichungen, BeispieleT = 10-a = 10^(-0.28) = 0,53
Das Elektrofotometer markiert 0,53*30 mV = 15,74 mV.
Gelöste Übungen
Übung 1
Es soll die molare Absorption einer bestimmten patentierten Verbindung bestimmen, die in Lösung ist. Dafür ist die Lösung mit Licht aus einer Natriumlampe von 589 nm beleuchtet. Die Probe wird auf eine Dicke von 1,50 cm platziert.
Es basiert auf einer Konzentrationslösung 4,00 × 10^-4 Mol pro Liter und die Durchlässigkeit wird gemessen, was zu 0,06 führt. Bestimmen Sie mit diesen Daten die molare Absorption der Probe.
Lösung
Erstens wird die Absorption bestimmt, was als die am wenigsten logarithmus basierenden Zehn der Sendanz definiert ist:
A = - log (t)
A = - log (0,06) = 1,22
Dann wird das Gesetz des Lambert-Beer verwendet, das eine Beziehung zwischen Absorption, molarer Absorption, Konzentration und optischer Länge herstellt:
A = εoge
Löschen der molaren Absorption Die folgende Beziehung wird erhalten:
ε = a/(cúd)
Ersetzen der angegebenen Werte:
ε = 1,22/(4,00 × 10^-4 m�1,5 cm) = 2030 (Múcm)^-1
Das vorherige Ergebnis wurde auf drei signifikante Ziffern gerundet.
Übung 2
Um die Genauigkeit zu verbessern und den Fehler des Maßes der molaren Absorbierung der Probe in Übung 1 zu bestimmen, wird die Probe nacheinander in der Hälfte der Konzentration verdünnt und die Transmission wird jeweils gemessen.
Ausgehend von CO = 4 × 10^-4 m mit Transmission t = 0,06 Die folgende Datensequenz für die Sendung und Absorption, die aus der Transmission berechnet wird, wird erhalten:
CO/1-> 0,06-> 1,22
CO/2-> 0,25-> 0,60
CO/4-> 0,50-> 0,30
CO/8-> 0,71-> 0,15
CO/16-> 0,83-> 0,08
CO/32-> 0,93-> 0,03
CO/64-> 0,95-> 0,02
CO/128-> 0,98-> 0,01
CO/256-> 0,99-> 0,00
Mit diesen Daten tun:
Es kann Ihnen dienen: Stationäre Wellen: Formeln, Eigenschaften, Typen, Beispielea) ein auf Konzentration basierendes Diagramm der Absorption.
b) eine lineare Einstellung der Daten und finden Sie die Steigung.
c) Berechnen Sie aus der erhaltenen Steigung die molare Absorbation.
Lösung
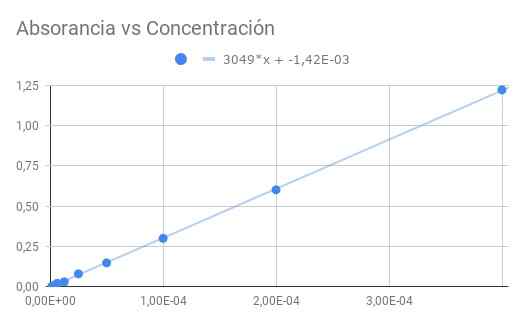 Figur 3. Absorption gegenüber Konzentration. Quelle: f. Zapata.
Figur 3. Absorption gegenüber Konzentration. Quelle: f. Zapata. Die erhaltene Steigung ist das Produkt der molaren Absoranivität durch den optischen Abstand. Daher wird die Steigung durch Länge 1,5 cm geteilt
ε = 3049/1,50 = 2033 (m Organ)^-1
Übung 3
Mit den Daten von Übung 2:
a) Berechnen Sie die Absoranivität für jeden Daten.
b) Bestimmen Sie einen Durchschnittswert für die molare Absorption, seine Standardabweichung und den statistischen Fehler, der mit dem Durchschnitt verbunden ist.
Lösung
Die molare Absorption wird für jede der getesteten Konzentrationen berechnet. Erinnern Sie sich daran, dass Beleuchtungsbedingungen und optischer Abstand fest bleiben.
Die Ergebnisse für die molare Absorption sind:
2033, 2007, 2007, 1983, 2158, 1681, 2376, 1,872, 1862 in Einheiten von 1/(M*cm).
Aus diesen Ergebnissen können wir den Durchschnittswert nehmen:
= 1998 (m*cm)^-1
Mit einer Standardabweichung von: 184 (m*cm)^-1
Der durchschnittliche Fehler ist die Standardabweichung geteilt durch die Quadratwurzel der Datennummer, dh:
Δ = 184/9^0,5 = 60 (m*cm)^-1
Schließlich wird der Schluss gezogen, dass die patentierte Substanz mit einer Frequenz von 589 nm, die durch eine Natriumlampe von einer Natriumlampe erzeugt wird, einen molaren Absorption hat:
= (2000 ± 60) (m*cm)^-1
Verweise
- Atkins, p. 1999. Physikalische Chemie. Omega -Ausgaben. 460-462.
- Der Führer. Durchlässigkeit und Absorption. Erholt von: Chemie.Laguia2000.com
- Umwelttoxikologie. Durchlässigkeit, Absorption und Gesetz von Lambert. Wiederhergestellt von: Repository.Innovationumh.Ist
- Abenteuerphysik. Absorption und Durchlässigkeit. Erholt von: rpfisica.Blogspot.com
- Sistophotometrie. Erholt von: Chem.Librettexts.Org
- Umwelttoxikologie. Durchlässigkeit, Absorption und Gesetz von Lambert. Wiederhergestellt von: Repository.Innovationumh.Ist
- Wikipedia. Absorption. Erholt von: Wikipedia.com
- Wikipedia. Spektrophotometrie. Erholt von: Wikipedia.com
- « Lateinamerikanischer Avant -Gart -Kontext, Eigenschaften, Autoren
- Totalitarismus Ursprünge, Merkmale, Ursachen und Folgen »

