Ammoniumacetatstruktur, Eigenschaften, Verwendung und Risiken

- 1972
- 402
- Jasmine Kupprion
Er Ammoniumacetat Es ist ein anorganisches Salz, dessen chemische Formel NH ist4CH3Cooh. Es stammt aus der Mischung von Essigsäure, die in kommerziellem Essig vorhanden ist, bis zu einer Konzentration von 5%und dem Ammoniak. Beide Startsubstanzen haben charakteristische Gerüche, daher ist es möglich, eine Vorstellung davon zu bekommen, warum dieses Salz nach Essig-Ammonia riecht.
Das größte Highlight dieses Salzes ist jedoch nicht sein Geruch, sondern sein niedriger Schmelzpunkt. Es ist so niedrig, dass es in jedem Labor in seiner flüssigen Version erhalten werden kann, in der Ionen frei fließen, um elektrische Lasten zu transportieren.
 Ammoniumacetatkristalle. Quelle: Vidak [Public Domain].
Ammoniumacetatkristalle. Quelle: Vidak [Public Domain]. Andererseits ist das Ammoniumacetat köstlich; das heißt, absorbieren Wasser oder Luftfeuchtigkeit der Umwelt, bis sie vollständig aufgelöst werden. Deshalb werden sie, obwohl sie in wasserfreiem Zustand weiß sind, schnell hell (wie im Becher des oberen Bildes).
Als solide Ammoniakquelle muss es so manipuliert werden, dass die Inhalation seiner Dämpfe minimiert wird. Aber trotz dieser negativen Eigenschaft das NH4CH3COOH ist nützlich für die Zubereitung von Pufferlösungen, die Lebensmittel behalten, während es ein Bestandteil bestimmter Lösungsmittelproteinextraktoren ist.
[TOC]
Ammoniumacetatstruktur
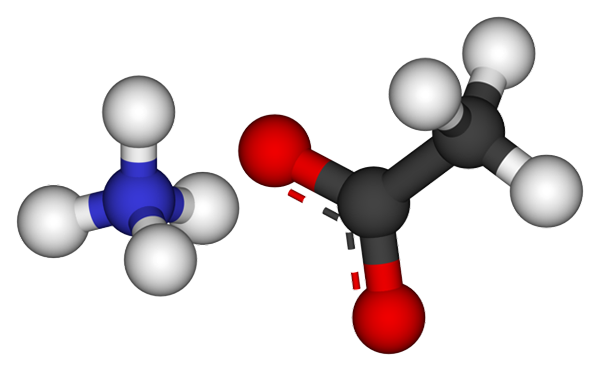 Ammoniumacetationen. Quelle: CCOIL [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Ammoniumacetationen. Quelle: CCOIL [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Das obere Bild zeigt die Ionen, aus denen das Ammoniumacetat in einem Kugeln und Stangenmodell besteht. Links befindet sich das tetraedrische Geometrie -Kation NH4+, Während der rechten Seite das molekulare Anion mit zwei demozierten Elektronen zwischen zwei Sauerstoffatomen, ch, CH3Gurren- (Die gepunktete Linie zwischen den roten Kugeln).
So beide Ionen, NH4+ und Ch3Gurren-, Sie bleiben durch ihre elektrostatische Anziehungskraft vereint, die zusammen mit den Abstoßungen zwischen den gleichen Lasten einen Kristall definiert. Dieser Ammoniumacetatkristall hat eine ortorrombische Struktur, die in mikroskopischen Proben oder sogar sichtbaren Größen beobachtet werden kann.
Kann Ihnen dienen: Ionic Link: Merkmale, wie es gebildet wird und BeispieleDie ionische Bindung für dieses Salz ist nicht nur wichtig, sondern auch Wasserstoffbrücken. Der NH4+ Sie können bis zu vier dieser Brücken spenden; Das heißt, in jedem der Eckpunkte seines Tetraeders gibt es ein Sauerstoffatom von einem Cho3Gurren- Nachbar (h3N+-H-och3).
Theoretisch sollten Kräfte in ihren Kristallen dann sehr stark sein; Experimentell tritt das Gegenteil auf, da es nur 114 ° C schmilzt. Daher kompensieren Wasserstoffbrücken weder die Schwäche ihrer ionischen Bindung noch die niedrige retikuläre Energie des nH -ortorrhrombischen Glas4CH3Gurren.
Andere Kompositionen und Wasser
Am Anfang wurde gesagt, dass Ammoniumacetat durch Mischen von Essigsäure und Ammoniasäure hergestellt wird. Daher kann Salz auch als: NH ausgedrückt werden3CH3Cooh. Daher können je nach Zusammensetzung andere Strukturen erhalten werden: NH3· 2Ch3Cooh, o nh3· 5ch3Zum Beispiel Cooh.
Es wurde auch erwähnt, dass es genug Feuchtigkeit absorbiert. Dabei enthält es Wassermoleküle in seine Kristalle, die hydrolysiert NH3 oder ch3Cooh; Und deshalb gibt Salz einen Geruch nach Ammoniak oder Essig aus.
Eigenschaften
Aussehen
Delitezische weiße Kristalle mit Essig- und Ammoniakgeruch.
Molmasse
77.083 g/mol.
Dichte
1.073 g/ml bei 25ºC.
Schmelzpunkt
114ºC. Dieser Wert ist im Vergleich zu anderen Salzen oder ionischen Verbindungen erheblich niedriger. Darüber hinaus fehlt es aufgrund der Bildung von Ammoniak einen Siedepunkt, der die Zersetzung von Salz impliziert.
Löslichkeit
143 g/100 ml bei 20ºC. Beachten Sie Ihre außergewöhnliche Wasserlöslichkeit, die die Affinität zeigt, die Wassermoleküle an den NH -Ionen empfinden4+ und Ch3Gurren-, Hying sie in wässrigen Kugeln.
Kann Ihnen dienen: Hume-rothery RegelnSeine Löslichkeit ist in weniger polaren Lösungsmitteln nicht so. Zum Beispiel in 100 ml Methanol bei 15 ° C 7,89 g NH löst sich auf4CH3Gurren.
Stabilität
Es ist köstlich, also sollten Sie es vermeiden, in feuchten Räumen zu lagern. Auch während die Absorption von Wasser Ammoniak frei.
PKA
9.9.
Diese Konstante entspricht der Säure des Ammoniumions:
NH4+ + B nh3 + Hb
Wobei HB eine schwache Säure ist. Wenn die B -Basis das Wasser ist, ist seine Hydrolysereaktion die Reaktion:
NH4+ + H2Oder NH3 + H3ENTWEDER+
In welchen Arten h3ENTWEDER+ Definieren Sie den pH -Wert der Lösung.
Andererseits trägt Acetat auch zum PH bei:
CH3Gurren- + H2Oder ch3Cooh + oh-
So sind beide Arten h3ENTWEDER+ und oh- Sie werden durch Angeben eines pH 7, neutralen, neutralisiert. Laut Pubchem haben hochkonzentrierte Lösungen von Ammoniumacetat jedoch einen sauren pH -Wert; was bedeutet, dass die NH -Hydrolyse vorherrscht4+ Über die Auswahl3Gurren-.
Standardtrainingenthalpie
ΔFH298 = -615 kJ/mol.
Anwendungen
Analytisch
Wässrige Natriumacetat -Lösungen ermöglichen es, Blei, Eisen und Zinksulfate zu löschen, um anschließend ihre Konzentration durch Atomabsorptionsspektroskopie zu bestimmen.
Halbfahrer
Als Mahlzeit mit niedriger Temperatur im Vergleich zu anderen Salzen kann seine Flüssigkeit zum Antrieb des elektrischen Stroms verwendet werden.
Puffer
Sie können pH -Veränderungen in sauren oder grundlegenden Intervallen regulieren, die verwendet werden, um einen konstanten pH -Wert in Fleisch, Pralinen, Käse, Gemüse oder anderen Lebensmitteln aufrechtzuerhalten.
Kann Ihnen dienen: MolybdänAuf Eis und Böden
Es ist ein biologisch abbaubares und relativ billiges Salz, das verwendet wird, um eisige Wege aufzuheben. Da es eine Quelle für wasserlösliche Stickstoff ist, ist es auch für landwirtschaftliche Verwendungen zur Bestimmung der Kaliumspiegel bestimmt.
Ausfällen
Dieses Salz wird verwendet, um Protein auszurüsten, um eine chromatographische Analyse durchzuführen.
Medizin
Ammoniumacetat wirkt als tierärztlicher Diuretikum und ist auch ein notwendiges Salz für Insulin- und Penicillin -Synthese.
Risiken
Als nächstes und schließlich werden einige negative Risiken oder Konsequenzen, die durch das Ammoniumacetat verursacht werden, aufgeführt:
- Es kann leichte Reizungen auf der Haut erzeugen, ohne sich darin zu nehmen.
- Wenn aufgenommen wird.
- Seine Inhalation irritiert Nase, Hals und Lungen.
Von den anderen ist nicht bekannt, ob Krebs erzeugen kann, und ein mögliches Feuerrisiko durch dieses Salz wird verworfen (zumindest unter normalen Speicherbedingungen).
Verweise
- Inger Nahringbauer. (1967). Wasserstoffbrückenbindungsstudien. Xiv. Die Kristallstruktur von Ammoniumacetat. Institut für Chemie, Universität von Uppsala, Uppsala, Schweden. Kristallat. 23, 956.
- Nationales Zentrum für Biotechnologie Information. (2019). Ammoniumacetat. Pubchem -Datenbank. CID = 517165. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Sullivan Randy. (2012). Leitfähigkeit von Ammoniumacetat. Erholt von: Chemdemos.Uoregon.Edu
- Viachem, Ltd. (S.F.). Ammoniumacetat. Erholt von: Viacheminc.com
- Wikipedia. (2019). Ammoniumacetat. Abgerufen von: in.Wikipedia.Org
- Das Gesundheitsministerium in New Jersey. (2012). Ammoniumacetat: Informationsblatt über gefährliche Substanzen. [PDF]. Erholt von: NJ.Regierung
- XUEYANGHU. (S.F.). Verwendung und Risiko von Ammoniumacetat. Erholt von: Xueyanghu.WordPress.com
- « Alizarineigenschaften, Vorbereitung, Verwendungszwecke und Toxizität
- Eisenhydroxid (III) Struktur, Eigenschaften und Verwendung »

