Ethylacetat
- 4743
- 628
- Timo Rabenstein
Er Ethyl- oder Ethylethanacetat Es ist eine organische Verbindung, deren chemische Formel Cho ist3COOC2H5. Es besteht aus einem Ester, bei dem die alkoholische Komponente aus Ethanol stammt, während seine Carbonsäure -Komponente aus Essigsäure stammt.
Es ist eine Flüssigkeit unter normalen Temperatur- und Druckbedingungen, die ein Aroma darstellt. Diese Eigenschaft tritt perfekt in Harmonie ein, so dass es von einem Ester erwartet wird. Das ist in der Tat die chemische Natur von Ethylacetat. Aus diesem Grund findet er in Lebensmittelprodukten und alkoholischen Getränken eingesetzt.
 Ethylacetat. Quelle: Commons Wikimedia.
Ethylacetat. Quelle: Commons Wikimedia. Das obere Bild zeigt die Skelettstruktur des Ethylacetatodens. Beachten Sie seine Carbonsäurekomponente und rechts die alkoholische Komponente. Aus struktureller Sicht kann erwartet werden, dass sich diese Verbindung wie ein Hybrid zwischen Essig und Alkohol verhalten. Es zeigt jedoch seine eigenen Eigenschaften.
Hier sind solche Hybriden, die sich Esters bezeichneten. Ethylacetat kann weder wie eine Säure reagieren, noch dehydrieren durch Abwesenheit einer OH -Gruppe. Stattdessen erleidet es eine grundlegende Hydrolyse in Gegenwart einer starken Basis wie Natriumhydroxid, NaOH.
Diese Hydrolysereaktion wird zum Unterrichten von Laboratorien für chemische Kinetikexperimente verwendet. Wo die Reaktion zusätzlich zweiter Ordnung ist. Wenn die Hydrolyse auftritt, Ethils Ethanoat.
In seinem strukturellen Skelett wird beobachtet, dass Wasserstoffatome auf Sauerstoff vorherrschen. Dies beeinflusst seine Fähigkeit, mit nicht so polaren Spezies wie Fetten zu interagieren. Es wird auch verwendet, um Verbindungen wie Harze, Farbstoffe und allgemeine organische Feststoffe aufzulösen.
Trotz eines angenehmen Aroms erzeugt eine längere Exposition gegenüber dieser Flüssigkeit einen negativen Einfluss (wie fast alle chemischen Verbindungen) auf den Körper.
Ethylacetatstruktur
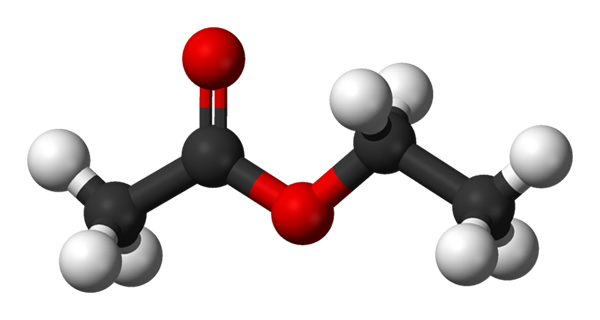
 Kugeln und Balkenmodell für Ethylacetat. Quelle: Benjah-BMM27 [Public Domain]
Kugeln und Balkenmodell für Ethylacetat. Quelle: Benjah-BMM27 [Public Domain] Das obere Bild zeigt die Struktur des Ethylacetats mit einem Modell von Kugeln und Balken. In diesem Modell werden Sauerstoffatome mit roten Kugeln hervorgehoben; Links ist die von Säure abgeleitete Fraktion und rechts die von Alkohol abgeleitete Fraktion (Alcoxi, -or).
Kann Ihnen dienen: Schwache Elektrolyte: Konzept, Eigenschaften, BeispieleDie Carbonylgruppe ist durch Link C = O (die Doppelbalken) zu sehen. Die Struktur um diese Gruppe und der benachbarte Sauerstoff ist flach, da die Resonanzbelastung zwischen beiden Sauerstoff verlagert wird; Tatsache, die eine relativ geringe Säure von α -Hydrogenen erklärt (die der -ch -Gruppe3, mit c = o verknüpft).
Das Molekül, das zwei seiner Glieder dreht, bevorzugt direkt, wie interagiert mit anderen Molekülen. Das Vorhandensein der beiden Sauerstoffatome und die Asymmetrie in der Struktur verleihen ihr ein dauerhaftes Dipolmoment; was wiederum für seine Dipol-Dipol-Wechselwirkungen verantwortlich ist.
Zum Beispiel ist die elektronische Dichte in der Nähe der beiden Sauerstoffatome größer und nimmt in der Gruppe -Ch -Gruppe erheblich ab3, Und allmählich in der OCH -Gruppe2CH3.
Aufgrund dieser Wechselwirkungen bilden Ethylacetatmoleküle unter normalen Bedingungen eine Flüssigkeit, die einen erheblich hohen Siedepunkt (77 ° C) aufweist (77 ° C).
Abwesenheit von Atomenspendern von Wasserstoffbrücken
Wenn die Struktur sorgfältig beobachtet wird, wird das Fehlen eines Atoms, das eine Wasserstoffbrücke spenden kann. Sauerstoffatome sind jedoch Akzeptoren von solchen, und Ethylacetat ist in Wasser sehr löslich und interagiert in einem geschätzten Ausmaß mit polaren Verbindungen und Spendern von Wasserstoffbrücken (wie Zucker).
Es ermöglicht Ihnen auch, hervorragend mit Ethanol zu interagieren. Grund, warum seine Anwesenheit in alkoholischen Getränken nicht überrascht ist.
Auf der anderen Seite lässt seine Alcoxi -Gruppe ihn in der Lage, mit bestimmten apolaren Verbindungen wie Chloroform, CH zu interagieren3Cl.
Physikalische und chemische Eigenschaften
Namen
-Ethylacetat
-Ethylethanoat
-Essigsethyl
-Acetoxietano
Molekularformel
C4H8ENTWEDER2 oder ch3COOC2H5
Molekulargewicht
88,106 g/mol.
Physische Beschreibung
Klare farblose Flüssigkeit.
Farbe
Farblose Flüssigkeit.
Geruch
Charakteristisch für die Ether, ähnlich dem Geruch von Ananas.
Geschmack
Schön, wenn es verdünnt ist, verleiht es ein Obstgeschmack in Bier.
Riechschwelle
3,9 ppm. 0,0196 mg/m3 (niedriger Geruch); 665 mg/m3 (Hoher Geruch).
Kann Ihnen dienen: Chemische BindungSchreckbarer Geruch bei 7 - 50 ppm (Mittelwert = 8 ppm).
Siedepunkt
171 ºF bei 760 mmHg (77,1 ºC).
Schmelzpunkt
-118,5 ºF (-83,8 ºC).
Wasserlöslichkeit
80 g/l.
Löslichkeit in organischen Lösungsmitteln
Mischbar mit Ethanol und Ethylether. Sehr löslich in Aceton und Benzol. Mischbar mit Chloroform, festen Ölen und flüchtigem und auch mit sauerstoffhaltigen und chlorierten Lösungsmitteln.
Dichte
0,9003 g/cm3.
Dampfdichte
3.04 (in Luftbeziehung: 1).
Stabilität
Es zersetzt sich langsam mit Feuchtigkeit; unvereinbar mit mehreren starken oxidierenden Kunststoffen und Wirkstoffen. Die Mischung mit Wasser kann explosiv sein.
Dampfdruck
93,2 mmHg bei 25 ºC
Schmiere
0,423 mpoise bei 25 ° C.
Verbrennungswärme
2.238.1 kJ/mol.
Verdampfungswärme
35,60 kJ/mol bei 25 ºC.
Oberflächenspannung
24 Dynas/cm bei 20 ° C.
Brechungsindex
1,373 bis 20 ° C/d.
Lagertemperatur
2 - 8 ºC.
PKA
16 - 18 bis 25 ° C.
Synthese
Fischerreaktion
Ethylacetat wird industriell durch Fisher -Reaktion synthetisiert, bei der Ethanol mit Essigsäure verärgert wird. Die Reaktion erfolgt bei Raumtemperatur.
CH3CH2OH +CH3Cooh ch3Cooch2CH3 + H2ENTWEDER
Die Reaktion wird durch Säurekatalyse beschleunigt. Das Gleichgewicht bewegt sich nach rechts, dh zur Produktion von Ethylacetat, indem er Wasser entfernen; Nach Massenaktionsgesetz.
Tishchenko -Reaktion
Ethylacetat wird auch industriell unter Verwendung der Tishchenko -Reaktion hergestellt, wobei zwei Acetaldehydäquivalente unter Verwendung eines Katalysators als Katalysator konjugiert.
2 Ch3Cho => cho3Cooch2CH3
Andere Methoden
-Ethylacetat wird als KO -Produkt bei der Oxidation von Butan zu Essigsäure in einer Reaktion bei einer Temperatur von 175 ° C und 50 atm Druck synthetisiert. Es wird als Kobaltkatalysator und Chromionen verwendet.
-Ethylacetat ist ein Co -Produkt des Polyvinylpolyvinylacetat -Ethanoly.
-Ethylacetat wird auch in der Industrie durch Dehydrierung von Ethanol hergestellt, die die Reaktion durch Verwendung von Kupfer bei hoher Temperatur, aber weniger als 250 ° C katalysiert.
Anwendungen
Lösungsmittel
Ethylacetat wird als Lösungsmittel und Verdünnungsmittel unter Verwendung der Leiterplattenreinigung verwendet. Es wird als Lösungsmittel bei der Herstellung von modifizierten Hops -Extrakten sowie in den entkoffeinierten Kaffee und Teeblättern verwendet. Es wird in den Tinten verwendet, um Obst und Gemüse zu markieren.
Es kann Ihnen dienen: Cyanhydsäure: Molekulare Struktur, Eigenschaften, verwendetEthylacetat wird in der Textilindustrie als Reinigungsmittel verwendet. Wird zur Kalibrierung von Thermometern verwendet, die bei der Zuckertrennung verwendet werden. In der Lackbranche wird es als Lösungsmittel und Verdünnung der verwendeten Materialien verwendet.
Künstliche Aromen
Es wird bei der Ausarbeitung von Obstaromen verwendet; Zum Beispiel: Banane, Birnen, Pfirsich und Ananas sowie Traubenaroma usw.
Analyse
Es wird zur Bestimmung von Wismut, Bor, Gold, Molybdän und Platin sowie Lösungsmittel des Taliums verwendet. Ethylacetat hat die Fähigkeit, viele Verbindungen und Elemente in wässriger Lösung zu extrahieren, wie z. B. Phosphor, Kobalt, Wolfram und Arsen.
Organische Synthese
Ethylacetat wird in der Branche als Reduzierer in der Viskosität der Harze verwendet. Es wird in Acetamidproduktion, Acetylacetat und Methylheptanon verwendet.
Chromatographie
In Laboratorien wird Ethylacetat als mobile Phase von Chromatographien in Säulen und als Extraktionslösungsmittel verwendet. Wenn Ethylacetat einen relativ niedrigen Siedepunkt haben, ist es leicht zu verdampfen, sodass Sie die gelösten Substanzen im Lösungsmittel konzentrieren können.
Entomologie
Ethylacetat wird in der Entomologie verwendet, um die in einem Behälter platzierten Insekten zu ersticken, wodurch deren Sammlung und Studie ermöglicht werden. Ethylacetat -Dämpfe töten das Insekt, ohne ihn zu zerstören und ihre Verhärtung zu vermeiden, was ihre Sammelversammlung erleichtert.
Risiken
-Die ldfünfzig Von Ethylacetat bei Ratten zeigt es eine geringe Toxizität an. Es kann jedoch Haut, Augen, Haut, Nase und Hals reizen.
-Die Exposition gegenüber hohen Werten kann Schwindel und Ohnmacht verursachen. Ebenso kann eine langfristige Exposition die Leber und Niere beeinflussen.
-Ethylacetat -Inhalation bei einer Konzentration von 20.000 - 43.000 ppm können Lungenödem und Blutung produzieren.
-Die Labour -Ausstellungsgrenze wurde von der OSHA auf 400 ppm in der Luft im Durchschnitt während einer 8 -stündigen Arbeitsverschiebung festgelegt.
Verweise
- Illustriertes Glossar der organischen Chemie: Ethhylacetat (ETOAC). Erholt von: Chem.UCLA.Edu
- Ethhylacetat. Abgerufen von: CHM.Bris.AC.Vereinigtes Königreich

