Isoamilo -Struktur, Eigenschaften, Synthese und verwendet Acetat

- 4346
- 1285
- Ivan Pressler
Er Isoamilo Acetat Es ist ein Ester, dessen molekulare Formel Cho ist3COO (Ch2)2Ch (Ch3)2. Bei Raumtemperatur besteht es aus einer öligen, klaren, farblosen, brennbaren und flüchtigen Flüssigkeit. In der Tat ist es ein zu volatiler und duftender Ester.
Sein Hauptmerkmal ist es, sich von einem Geruch zu verabschieden, der zum Aroma vieler Früchte beiträgt, insbesondere der von Bananen oder Bananen. Auch diese letzte Frucht stellt eine ihrer natürlichen Quellen als Exzellenz aus.
 Bananen, deren charakteristisches Aroma auf Isoamiloacetat zurückzuführen ist. Quelle: Pixabay.
Bananen, deren charakteristisches Aroma auf Isoamiloacetat zurückzuführen ist. Quelle: Pixabay. Von dort aus dem Namen Bananenöl, der einer Isoamil -Acetatlösung oder einer Mischung aus Isomylacetat mit Nitrocellulose angegeben wird. Die Verbindung wird weit verbreitet als Aroma aus Lebensmitteln, Eis und Süßigkeiten.
Darüber hinaus wird es bei der Ausarbeitung von Düften mit unterschiedlichen Arbeitsplätzen verwendet. Es ist auch ein Lösungsmittel, das bei der Extraktion von Metallen und organischen Verbindungen wie Essigsäure verwendet wird.
Isoamiloacetat ist das Ergebnis der Sterifizierung von Isoamylalkohol mit Essigsäure. In Laboratorien für organische Chemieunterricht stellt diese Synthese eine interessante Erfahrung dar, um die Veresterung umzusetzen, während das Labor mit Bananenduft überflutet wird.
[TOC]
Isoamilo Acetatstruktur
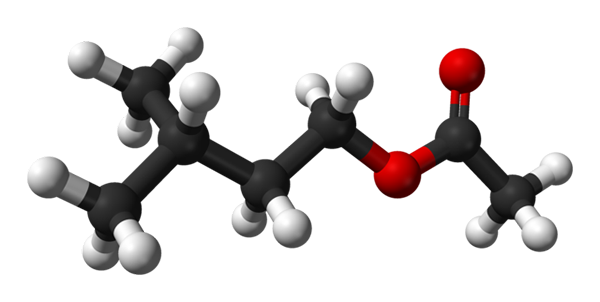 Isoamilo Acetatstruktur. Quelle: Ben Mills [Public Domain]
Isoamilo Acetatstruktur. Quelle: Ben Mills [Public Domain] Im oberen Bild haben Sie die molekulare Struktur des Isoamil -Acetats mittels eines Kugeln- und Balkenmodells. Die roten Kugeln entsprechen Sauerstoffatomen, insbesondere denen, die diese Verbindung als Ester identifizieren; Sein Teil von Ether, R-O-R und der Carbonylgruppe, c = o, dann die strukturelle Formel r''Coor.
Links, r'', Sie haben das isopentile alkyglische Radikal (Cho3)2CHCH2CH2; Und rechts, r, zur Methylgruppe, zu der das "Acetat" des Namens dieses Esters geschuldet ist. Es ist ein relativ kleiner Ester, der in der Lage ist, mit den chemischen Rezeptoren des Geruchs unserer Nasen zu interagieren, was zu Signalen führt.
Kann Ihnen dienen: verzweigte AlkaneIntermolekulare Wechselwirkungen
Das Isoamil -Acetatmolekül selbst ist flexibel; Das Isopentil-Radikal kommt jedoch nicht den intermolekularen Wechselwirkungen zugute, da es verzweigt wird und Sauerstoffatome sterisch verhindert.
Auch diese beiden Sauerstoff können Wasserstoffbrücken nicht akzeptieren; Strukturell hat das Molekül nicht, wie man sie spendet. Angesichts der unterbrochenen Dipole kann Isoamil Acetat intermolekular durch Londoner Dispersionskräfte interagieren. die direkt proportional zu ihrer molekularen Masse sind.
Somit ist es die molekulare Masse des Esters, das für seine Moleküle verantwortlich ist, um eine Flüssigkeit mit einem hohen Siedepunkt (141 ° C) zu bilden. Ebenso ist es für seine feste Abdeckung auf eine Temperatur von -78 ° C verantwortlich.
Bananenduft
Seine intermolekularen Kräfte sind so schwach, dass die Flüssigkeit flüchtig genug ist, um ihre Umgebung mit Bananengerüchen durchzuführen. Interessanterweise kann sich der süße Geruch dieses Ester ändern, wenn die Anzahl der Kohlenstoffe reduziert oder erhöht wird.
Das heißt, wenn er anstatt sechs aliphatische Kohlenstoffe zu haben, hatte er fünf (mit dem radikalen Isobutil), sein Geruch würde dem von Himbeeren ähneln; Wenn das Radikal der Abschnitt wäre, würde der Geruch mit Spuren organischer Lösungsmittel beladen; Und wenn ich mehr als sechs Kohlenstoffe hätte, würde der Geruch zu Seife und Metallic werden.
Eigenschaften
Chemische Namen
-Isoamilo Acetat
-Isopentile Ethanoat
-3-Methylbutilo-Acetat
-Isopentilo Acetat
-Bananenöl oder Banane.
Molekularformel
C7H14ENTWEDER2 oder ch3COO (Ch2)2Ch (Ch3)2
Molekulargewicht
130.187 g/mol.
Physische Beschreibung
Es ist eine ölige, klare und farblose Flüssigkeit.
Geruch
Bei Raumtemperatur hat es einen intensiven und angenehmen Geruch von Bananen.
Geschmack
Es hat einen ähnlichen Geschmack wie der von Birne und Apfel, der präsentiert wird.
Siedepunkt
124,5 ºC.
Schmelzpunkt
-78,5 ºC.
Zündungspunkt
92 ºF geschlossene Tasse (33 ºC); Tasse 100 ºF (38 ºC) geöffnet.
Können Sie dienen: Kristalline Feststoffe: Struktur, Eigenschaften, Typen, BeispieleWasserlöslichkeit
2.000 mg/l a 25 ° C.
Löslichkeit in organischen Lösungsmitteln
Mit Alkohol, Äther, Ethylacetat und Amylalkohol mischbar.
Dichte
0,876 g/cm3.
Wasserdampfdichte
4.49 (in Luftbeziehung = 1).
Dampfdruck
5,6 mmHg bei 25 ° C.
Self -Anmut -Temperatur
680 ºF (360 ºC).
Schmiere
-1,03 CPOISE bei 8,97 ºC
-0,872 CPOISE bei 19,91 ºC.
Verbrennungswärme
8.000 Lime/g.
Riechschwelle
Luft = 0,025 µl/l
Wasser = 0,017 mg/l.
Brechungsindex
1.400 bis 20 ° C.
Relative Verdunstungsgeschwindigkeit
0,42 (in Bezug auf Butylacetat = 1).
Dialektrische Konstante
4,72 bis 20 ° C.
Lagerung
Isoamilo Acetat ist eine brennbare und flüchtige Verbindung. Daher muss es in völlig hermetischen Behältern kalt sein, weit entfernt von brennbaren Substanzen.
Synthese
Es wird durch die Veresterung von Isoamylalkohol mit Gletscherlecksäure in einem Prozess als Fisher -Verstärkung erzeugt. Schwefelsäure wird normalerweise als Katalysator verwendet, aber auch p-toluenosulfonsäure katalysiert die Reaktion:
(CH3)2Ch-ch2-CH2CH2OH + CH3Cooh => ch3Cooch2-CH2-CH2-Ch (Ch3)2
Anwendungen
Speisen- und Getränkearoma
Es wird verwendet, um ein Birnengeschmack in Wasser und Sirupen zu verleihen. Es wird in China verwendet, um Obstaromen wie Erdbeer, Brombeere, Ananas, Birne, Apfel, Traube und Banane zuzubereiten. Die verwendeten Dosen sind: 190 mg/kg in Süßwaren; 120 mg/kg in Gebäck; 56 mg/kg in Eis; und 28 mg/kg in Erfrischungsgetränken.
Lösungsmittel und Verdünnungsmittel
Es ist ein Lösungsmittel für:
-Nitrocellulose und Celluloid
-Wasserdichtes Lack
-Ester Gummi
-Vinylharz
-Cummarona Harz und Rizinusöl.
Es wird als Lösungsmittel für die Chrombestimmung verwendet und als Eisen-, Kobalt- und Nickel -Extraktionsmittel verwendet. Es wird auch als Lösungsmittel für Ölgemälde und alte Lack verwendet. Außerdem wird es bei der Ausarbeitung von Nagellack verwendet.
Dieser Ester wird als Verdünnungsmittel in der Essigsäureproduktion verwendet. Öl wird in einem Oxidationsprozess als Rohstoff verwendet.
Kann Ihnen dienen: Ethylenglykol: Eigenschaften, chemische Struktur, verwendetAls Lösungsmittel und Träger anderer Substanzen wurde es zu Beginn der Luftfahrtindustrie verwendet, um die Stoffe vor den Luftflügeln zu schützen.
Düfte
-Es wird als Atmosphäre verwendet, um die schlechten Gerüche zu vertuschen.
-Es wird als Parfüm in Schuhen verwendet.
-Um die Effizienz von Antigase -Masken zu beweisen, da Isoamil Acetat einen sehr geringen Geruchsschwellenwert aufweist und nicht sehr giftig ist.
-Es wird in Düften wie Chipre verwendet; das weiche Aroma Osmanthus; Der Jacinto; und der starke orientalische Geschmack, der in niedrigen Dosen verwendet wird, niedriger als 1%.
Andere
Es wird in der Ausarbeitung von Seiden- und künstlichen Perlen, fotografischen Filmen, wasserdichten und bronzierenden Lacken verwendet. Es wird auch in der Textilindustrie zum Färben und Abschluss verwendet. Es wird zum trockenen Waschen von Kleidungsgegenständen und Stoffmöbeln verwendet.
Darüber hinaus wird Isoamilo -Acetat in Rayon Ausarbeitung verwendet, einem synthetischen Gewebe; In der Penicillin -Extraktion und als Standardchromatographie -Substanz.
Risiken
Isoamilo Acetat kann die Haut und die Augen durch physischen Kontakt reizen. Inhalation kann Nasenreizungen, Hals und Lungen verursachen. In der Zwischenzeit kann die Exposition gegenüber hohen Konzentrationen Kopfschmerzen, Schläfrigkeit, Schwindel, Schwindel, Müdigkeit und Ohnmacht verursachen.
Ein längerer Kontakt mit der Haut kann ihre Trockenheit und Risse verursachen.
Verweise
- Bilbrey Jenna. (30. Juli 2014). Isoamylacetat. Chemiewelt von der Royal Society of Chemistry. Erholt von: Chemistryworld.com
- Nationales Zentrum für Biotechnologie Information. (2019). Isoamylacetat. Pubchem -Datenbank. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Wikipedia. (2019). Isoamylacetat. Abgerufen von: in.Wikipedia.Org
- Royal Society of Chemistry. (2015). Isoamylacetat. Chemspider. Erholt von: Chemspider.com
- New Jersey Department of Health und Senior Services. (2005). Isoamylacetat. [PDF]. Erholt von: NJ.Regierung
- Chemisches Buch. (2017). Isoamylacetat. Erholt von: Chemicalbook.com
- « 4 Zeiträume der Chemie von der Vorgeschichte bis heute
- Politische Sprachmerkmale, Typen, Themen und Beispiele »

