Bleiacetatstruktur, Eigenschaften, erhalten, verwendet, verwendet

- 1542
- 122
- Ibrahim Steuk
Er Bleiacetat o Bleiacetat (II) ist eine Verbindung, die durch ein Blei -Ion (PB) gebildet wird2+) und zwei Acetationen (ch3Gurren-). Seine chemische Formel ist (Cho3Gurren)2PB oder auch PB (wählen Sie3Gurren)2.
Es ist auch als "Bleizucker" bekannt für einen süßen Geschmack. Es ist jedoch eine sehr giftige Substanz. Es ist ein sehr löslicher kristalline Feststoff im Wasser. Sie können leicht mit Wasserstoffsulfid reagieren (h2S) Erzeugen von braunem Bleisulfid (PBS), das zum Nachweis dieses giftigen Gas in industriellen Prozessen verwendet wird.
 Solide Blei (ii) Acetat. Dormaothemist bei English Wikipedia/CC BY (https: // creativecommons.Org/lizenzen/bis/3.0). Quelle: Wikimedia Commons.
Solide Blei (ii) Acetat. Dormaothemist bei English Wikipedia/CC BY (https: // creativecommons.Org/lizenzen/bis/3.0). Quelle: Wikimedia Commons. In der Antike wurde es relativ leicht erhalten, so dass es Verwendungszwecke hatte, die derzeit aufgrund der Toxizität dieser Verbindung vollständig verboten sind.
Bleiacetatpulver sollte in der Umwelt nicht verteilt werden, da es explosive Gemische mit Sauerstoff bildet. Darüber hinaus ist es eine krebserregende Verbindung für Tiere und Menschen.
Es wird in organischen Geweben leichter absorbiert als andere Bleiverbindungen. Es neigt dazu, in Lebewesen bioakkumuliert zu werden, daher sollte es nicht in die Umwelt verworfen werden.
[TOC]
Struktur
Das Bleiacetat (ii) hat die in der folgende Abbildung gezeigte Struktur:
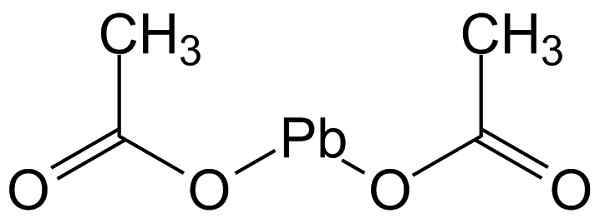 Molekülstruktur von Bleiacetat (II). Michał Sobkowski/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons.
Molekülstruktur von Bleiacetat (II). Michał Sobkowski/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons. Nomenklatur
- Bleiacetat (II)
- Bleidiacetat
- Ethanoat führen
- Plumboso Acetat
- Bleizucker
- Saturnsalz
Eigenschaften
Körperlicher Status
Kristalline Feste farblos zu Weiß.
Molekulargewicht
325 g/mol
Schmelzpunkt
280 ºC
Siedepunkt
Nicht kochen. Er bricht zusammen, wenn er erhitzt ist.
Dichte
3,25 g/cm3
Löslichkeit
Sehr löslich in Wasser: 44,3 g/100 ml bei 20 ° C. Unlöslich in Alkohol.
pH
Eine wässrige Lösung auf 5% hat einen pH-Wert von 5,5-6,5.
Chemische Eigenschaften
Wenn der PB (OCOCH3)2 Es löst in Wasser ein Teil wie folgt ionisiert:
PB (OCOCH3)2 → Pb2+ + 2 Ch3Gurren-
Ein Teil der Moleküle ist jedoch nicht ionisiert und bleibt in der Form:
CH3COO-PB-Ococh3.
Wenn das PB -Ion2+ Geben Sie die Lösung teilweise hydrolysiert in Wasser, das die PB -Spezies erzeugt4(OH)44+.
Wässrige Pb (II) -Acetatlösungen lösen Bleioxid (PBO) auf.
Es kann Ihnen dienen: ButenoReagiert mit Wasserstoffsulfid (H)2S) um ein braunes Blei aus Bleisulfid (PBS) zu bilden.
PB (OCOCH3)2 + H2S → PBS + 2 CH3Cooh
Wenn eine wässrige Ammoniaklösung zugesetzt wird (NH3) Ein weißer Niederschlag oder ein weißes Acetat -Feststoff von Basicetat wird zu einem Blei von Bleiacetat gebildet.
Andere Eigenschaften
Emittiert einen Geruch ähnlich dem von Essig. Es hat einen süßen Geschmack. Die häufigste kommerzielle Form ist PB Trihydrate (CH3Gurren)2 •3H2ENTWEDER.
 Blei -Acetat -Trihydrat. Leiem/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons.
Blei -Acetat -Trihydrat. Leiem/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons. Erhalten
Es kann durch Auflösen von Oxid oder Bleicarbonat (II) in konzentrierter Essigsäure hergestellt werden. Es können auch kleine dünne metallische Bleiplatten verwendet werden.
PBO + 2 CH3Cooh → (ch3Gurren)2PB + H2ENTWEDER
Alte Verwendungen
In Behandlung
Es wurde in verdünnte Lösung verwendet, um sie als Umschlag anzuwenden und in Entzündungen, die durch Gift Ivy verursacht wurden. Auch um Durchfall zu behandeln.
In Tierärzten
Es wurde als adstringierende und beruhigende Lotion bei der Behandlung von oberflächlichen Entzündungen und Blutergüssen verwendet.
In Kosmetika
Es wurde in der alten römischen Zeit hergestellt. Einige Frauen wandten es auf ihr Gesicht an, um blass zu erscheinen, was nicht nur eine Mode war, sondern auch eine Frage des sozialen Status.
Ein weißer Teint zeigte, dass die Frau nicht zur Arbeiterklasse gehörte, sondern zu den höchsten Ebenen der römischen Gesellschaft. Und dies geschah trotz der Tatsache, dass die Ärzte der Zeit wie Plinio El Viejo einige seiner schädlichen Wirkungen kannten.
Als Süßstoff von Getränken
Aufgrund seines süßen Geschmack.
In mehreren Anwendungen
Einige dieser Verwendungen gelten noch, aber die konsultierte Literatur ist nicht klar:
- In Chrompigmenten, als Bestandteil in Klebstofffarbstoffen, in trockenen organischen Seifen für Gemälde, Lacken und Tinten wie Wasserschutzmittel in Anti -Biting -Farben.
- Im Prozess des Erhaltens von Gold durch Cyaniden, um Metalle mit Blei abzudecken.
- Als untermordant in Baumwollfarbstoffen, Bestandteil des Fixierens von Bädern zum Druckpapier mit Sonnenlicht.
- Marke und Möbel im Freien zu behandeln und somit die Entfernung von Wirkstoffen zu verhindern, die vor Schimmel und Regenverschlechterung schützen.
Aktuelle Verwendungszwecke
In H -Erkennung2S
In bestimmten industriellen Prozessen wird es verwendet, um giftiges H zu erkennen2S in gasförmigen Strömen durch eine Versuchsrolle, in der es als Indikator dient. Die Erkennungsgrenze beträgt 5 ppm (Teile pro Million).
 Bleiacetat (ii) ermöglicht es, h zu erkennen2S in Industriegasen, damit dieses giftige Gas nicht in die Atmosphäre freigesetzt wird. Autor: Leestillaolcom. Quelle: Pixabay.
Bleiacetat (ii) ermöglicht es, h zu erkennen2S in Industriegasen, damit dieses giftige Gas nicht in die Atmosphäre freigesetzt wird. Autor: Leestillaolcom. Quelle: Pixabay. In jüngsten Tests wurde Nanofibras zusammen mit einem Polymer integriert, das zu einem neuen Nachweismaterial führt, das das Vorhandensein von 400 ppb (Teile pro Milliarde) von H ermöglicht2S sogar Feuchtigkeit von 90%.
Das hohe Potenzial dieser Nanomaterial als kolorimetrischer Sensor macht es für die Erkennung von H anwendbar2S im Atem von Menschen, die an einer Halitose leiden, deren Bereich unter 1 ppm liegt.
 Die neuen Nanofasern, die PB enthalten (CH3Gurren)2 Sie können sehr kleine Mengen von H erkennen2S im Atem. Autor: Natalia ovcharenko. Quelle: Pixabay.
Die neuen Nanofasern, die PB enthalten (CH3Gurren)2 Sie können sehr kleine Mengen von H erkennen2S im Atem. Autor: Natalia ovcharenko. Quelle: Pixabay. Bei der Erlangung anderer Verbindungen
Es ermöglicht die Herstellung anderer Bleiverbindungen wie Carbonat und Chromat, Bleisalze mit hohem Molekulargewicht und Antioxidationsmittelfettsäuren für Gummi.
Zum externen Gebrauch
Nach einigen konsultierten Quellen wird diese Verbindung immer noch in Haarfarbstoffen verwendet, deren Anwendungsanzeigen warnen, dass sie nicht in anderen Körperteilen verwendet werden sollte.
Es ist auch Teil von Analgetika -Produkten und Hautschutzern externer Gebrauch.
In beiden Fällen gibt es jedoch nicht genügend Beweise, um den Sicherheitsgrad dieser Produkte zu ermitteln. In Ländern wie Kanada und im US -Bundesstaat Kalifornien wurde die Verwendung in allen Arten von Kosmetika oder für die Anwendung auf der Haut verboten.
Risiken
Für Sicherheit
Es ist kein Brennstoff, aber es ist in der Umgebung in Form feiner Partikel verteilt, kann explosive Gemische mit der Luft erzeugen.
Es sollte weit entfernt von oxidierenden Verbindungen, starken Säuren und chemisch aktiven Metallen sowie in Bereichen ohne Abflüsse oder Zugang zu Abwasserkanälen gelagert werden, die zu Abwasser führen.
Für die Gesundheit
Es kann die Augen, den Atemweg und das Verdauung reizen und Kopfschmerzen, Übelkeit, Erbrechen, Kolik, Muskelschwäche, Krämpfe, Anfälle, Lähmung, Schwindel, Bewusstseinsverlust, Koma und sogar Tod verursachen.
Es kann Ihnen dienen: Hyposulfurous SäureBleiacetat wird etwa 1,5 -mal schneller absorbiert als andere Bleiverbindungen.
 Leiten Sie Acetat negativ beeinflusst das Gehirn der Kinder. Autor: Pete Lyforth. Quelle: Pixabay.
Leiten Sie Acetat negativ beeinflusst das Gehirn der Kinder. Autor: Pete Lyforth. Quelle: Pixabay. Eine sehr niedrige Blutkonzentration bei Kindern kann Hyperaktivität oder neurokonditionelle Behinderung verursachen, da sie Auswirkungen auf das Nervensystem erzeugt. Es kann auch Anämie und Schäden an den Nieren erzeugen.
Bei Tieren wurde es ausreichend nachgewiesen, dass es für die Fortpflanzung, Karzinogen und Teratogene giftig ist. Es wird geschätzt, dass Menschen auf die gleiche Weise beeinflussen.
Für die Umwelt
Es wird als gefährliche Substanz für die Umwelt angesehen, da es ein giftiger Schadstoff ist. Es ist sehr schädlich für Wasserorganismen. Besondere Aufmerksamkeit sollte Vögeln, Säugetieren, Bodenverschmutzung und Wasserqualität gelegt werden.
Bioacumulation dieser Verbindung in Pflanzen und Tieren kann auftreten. Internationale ökologische Institutionen erlauben nachdrücklich nicht, in die Umwelt zu gelangen, da sie anhaltend ist.
Historischer Vergiftungsfall
Eine der untersuchten Ereignisse war die des Präsidenten des Vereinigten Staaten Andrew Jackson (1767-1845), das sich einer Behandlung mit "Bleizucker" unterzogen hatte, was zu dieser Zeit ein traditionelles Mittel mit unterschiedlichen Zwecken war.
Im Jahr 1999 wurden Maßnahmen an zwei im Leben des Präsidenten erhaltenen Haarproben durchgeführt, und es wurde festgestellt.
 Andrew Jackson war berauscht von Bleibasis. Autor: Gordon Johnson. Quelle: Pixabay.
Andrew Jackson war berauscht von Bleibasis. Autor: Gordon Johnson. Quelle: Pixabay. Sowohl ihre Buchstaben als auch ihr Biograf beschreiben, dass er unter anderem Symptome wie Übelkeit, Bauchkrämpfe und paralytische Rheuma vorgestellt hat. Aber nach einer Weile gab Jackson die Behandlung von Bleiacetat auf, sodass sich seine Gesundheit verbesserte.
Daher wird geschätzt, dass sein Tod wahrscheinlich nicht auf Bleivergiftungen zurückzuführen war.
Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Blei (ii) Acetat. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Blei, d.R. (Herausgeber) (2003). CRC -Handbuch für Chemie und Physik. 85th CRC Press.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Ghazi, a.M. und Millette, J.R. (1964). Führen. Bleiacetat. In forensischer Umwelt. Von Scientedirect erholt.com.
- Mushak, p. (2011). Blei und öffentliche Gesundheit. In Spurenmetallen und Oher -Verunreinigungen in der Neidung. Von Scientedirect erholt.com.
- Cha, j.-H. et al. (2018). Kolorimetrischer Sensor von Unterparts pro Million Wasserstoffsulfid: Blei-Nanofasern zur Halitosediagnose. Anal Chem 2018 Aug 7; 90 (15): 8769-8775. NCBI erholte sich.NLM.NIH.Regierung.
- Wikimedia Foundation (2020). Blei (ii) Acetat. Abgerufen von.Wikipedia.Org.
- Stewart, s. (2015). "Glänzend und tödlich weiß". Ein fairer Teint. In der Geschichte der Toxikologie und der Umweltgesundheit. Von Scientedirect erholt.com.
- Deppisch, l.M. et al. (1999). Andrew Jacksons Exposition gegenüber Quecksilber und Lead: vergifteter Präsident? Jama 1999 Aug 11; 282 (6): 569-71. NCBI erholte sich.NLM.NIH.Regierung.
- « Bleinitratstruktur, Eigenschaften, erhalten, verwendet, verwendet, verwendet
- Blei -Iodid -Struktur, Eigenschaften, erhalten, verwendet, verwendet »

