Kaliumacetatstruktur, Eigenschaften, Verwendungen, erhalten
- 2782
- 255
- Tizian Liebich
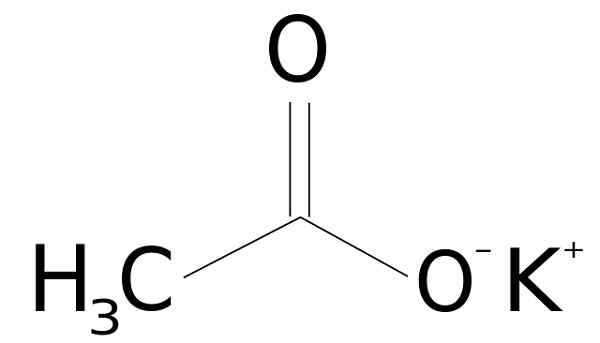
Er Kaliumacetat Es ist eine organische Verbindung, die von einem Ion Kalium k gebildet wird+ und ein Ionacetat Cho3Gurren-. Seine chemische Formel ist Cho3Kochen oder kch3COO oder auch c2H3Ko2. Es ist ein farbloses oder weißes kristallines Feststoff, sehr löslich im Wasser.
Es wird verwendet, um die Säure bestimmter industriell verarbeiteter Lebensmittel zu regulieren. Aufgrund seiner großen Affinität zu Wasser wird es in Laboratorien oder in bestimmten Prozessen verwendet, um Wasser aus anderen Verbindungen zu absorbieren, z. B. Alkohol dehydrieren.
 KCH Kaliumacetat3CO dient dazu, die Säure einiger verarbeiteter Lebensmittel zu regulieren. Autor: Ritae. Quelle: Pixabay.
KCH Kaliumacetat3CO dient dazu, die Säure einiger verarbeiteter Lebensmittel zu regulieren. Autor: Ritae. Quelle: Pixabay. Kaliumacetat beteiligt sich an einigen chemischen Reaktionen wie ihrem Beschleuniger und an der Synthese organischer Verbindungen. Es ermöglicht auch eine zunehmende Antikörperbildung (natürliche Substanzen, die Infektionen bekämpfen) in industriellen Methoden, um sie zu produzieren.
Seine Eigenschaften bei sehr niedrigen Temperaturen machen es zu einem guten Kandidaten, der in Gemischen verwendet werden kann, um Eis auf Betonstraßen in sehr kalten Klimazonen zu schmelzen. Laut Quellen, die konsultiert sind, wird es auch in Geräten zur Bekämpfung von Bränden und Ansammlungen verwendet, um Zellen in Mikroskopen zu beobachten.
[TOC]
Struktur
Kaliumacetat wird durch ein Kaliumkation K gebildet+ und ein Anion Acetat Cho3Gurren-. Letzteres ist die konjugierte Basis von Essigsäure ch3Cooh. Das Acetat Cho3Gurren- besteht aus einem Methyl -Ch3 zusammen mit einem Carboxylat -coo-.
Die Vereinigung zwischen beiden Ionen ist elektrostatisch oder ionisch, dh die Vereinigung zwischen einem positiven und einem negativen Ion.
 Kaliumacetatstruktur ch3Kochen. SSSILVER [gemeinfrei]. Quelle: Wikimedia Commons.
Kaliumacetatstruktur ch3Kochen. SSSILVER [gemeinfrei]. Quelle: Wikimedia Commons. Nomenklatur
- Kaliumacetat
- Kaliumethanoat
- Essigsäure Kaliumsalz
- ACOK
- KOAC
Eigenschaften
Körperlicher Status
Farbloser fester oder kristalline Weiß.
Molekulargewicht
98,14 g/mol
Schmelzpunkt
292 ºC
Dichte
1,6 g/cm3
Löslichkeit
Sehr löslich in Wasser: 256 g/100 ml bei 20 ° C.
pH
Eine 5% ige wässrige Lösung von Kaliumacetat hat einen pH-Wert von 7,5 bis 9,0.
Andere Eigenschaften
Manchmal hat es einen schwachen Geruch nach Essig. In 10% Lösung greift die Metall nicht Aluminium bei Raumtemperatur an, sondern bei 60-70 ° C und leidet bei Bissen.
Bei Konzentrationen von 20% oder mehr tritt der Oberflächenangriff auf Aluminium bei jeder Temperatur auf.
Kann Ihnen dienen: HydraceKaliumacetat (ACOK) ist in Wasser sehr löslich. Es hat ein Hydrat: das KCH3Gurren.1,5h2Oder, was der Feststoff ist, der erhalten wird, indem er ihn aus den wässrigen ACOK -Lösungen kristallisiert wird.
Verhalten beim Erhitzen
Wenn das Kaliumacetat (ACOK) (KCH (KCH) der Heizung (KCH) unterzogen wird3Gurren.1,5h2O) Nach Erreichen von 40 ° C beginnt das Hydratationswasser zu verlieren.
Kch3Gurren.1,5h2O → kch3COO + 1,5H2Oder ↑
Wenn das wasserfreie Kaliumacetat erhitzt wird (ohne Wasser: KCH3COO) beim Erreichen von 340 ° C beginnt es zu zersetzen, Kaliumcarbonat K zu bilden2CO3 Nach der folgenden Reaktion:
2 kch3COO + 4 o2 → k2CO3 + 3 h2O + 3 co2↑
Erhalten
Es kann durch die Wirkung von Koh -Kaliumhydroxid auf mehrere Verbindungen wie Cho Säure hergestellt werden3Cooh, Essigsäureanhydrid (CH3CO)2O und Ammoniumacetat Cho3Poonh4.
Koh +ch3COOH → CH3Kochen + h2ENTWEDER
Es kann auch durch Reaktion von Kaliumcarbonat k erhalten werden2CO3 o KHCO -Kaliumbicarbonat3 Mit Essigsäure ch3Cooh.
Khco3 + CH3COOH → CH3Kochen +h2Oder + co2↑
Kaliumacetat kann aus einer wässrigen Lösung kristallisiert werden, um es mit hoher Reinheit zu erhalten.
Anwendungen
In mehreren Anwendungen
Kaliumacetat wird in der verarbeiteten Lebensmittelindustrie als Säuregulator verwendet. Es wird in chemischen Methoden als Trockenmittel verwendet, um die Wasserdampfpermeabilität einiger Stoffe zu messen.
Es dient als dehydrierender Agent von Ethanol bei der Herstellung dieses Alkohols auf der Grundlage von Lignocellulose, einem aus Holz stammenden Material.
Es wird zur Herstellung von Antibiotika verwendet und wird in Brandbekämpfungsausrüstung häufig verwendet.
In der Polymerindustrie
Es wird verwendet, um Polyurethane zu recyceln.
Es wird auch bei der Herstellung von organischen Silikonharzen verwendet.
In wissenschaftlichen und medizinischen Forschungslabors
Hochreinheit Kaliumacetat wird in Laboratorien als analytisches Chemie -Reagenz verwendet. Auch um medizinische Forschung durchzuführen.
Kann Ihnen dienen: Neon: Geschichte, Eigenschaften, Struktur, Risiken, verwendetIn Histopathologie Laboratorien dient es, um ein neutrales pH -Medium in Mikroskopanordnung zu gewährleisten.
 Kaliumacetat hat verschiedene Verwendungszwecke in chemischen und medizinischen Forschungslaboratorien. Autor: Michal Jarmoluk. Quelle: Pixabay.
Kaliumacetat hat verschiedene Verwendungszwecke in chemischen und medizinischen Forschungslaboratorien. Autor: Michal Jarmoluk. Quelle: Pixabay. Es wird zur Synthese heterocyclischer organischer Verbindungen verwendet, die Verbindungen mit Zyklen unterschiedlicher Größe sind.
Bestimmte Mikroelektroden, die zur Untersuchung der elektrischen Eigenschaften von Zellen dienen, werden mit einer konzentrierten Kaliumacetatlösung gefüllt.
In der industriellen Produktion von Antikörpern
Kaliumacetat dient der großen Produktion von monoklonalen Antikörpern (die aus derselben Stammzelle stammen) in Zellkulturen. Es ermöglicht die Synthese oder Antikörperbildung.
Antikörper sind Substanzen, die von einigen Blutzellen zur Bekämpfung von Viren oder Bakterieninfektionen produziert werden.
 Künstlerisches Antikörperbild. KCH Natriumacetat3CO dient in der Produktion von Antikörpern in großen Mengen. Blitzkrieg1982 [CC BY-SA (https: // CreeveCommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.Obwohl Kaliumacetat (ACOK) das Zellwachstum hemmt oder versagt und die Zelldichte verringert, nimmt die Antikörperproduktivität für jede Zelle zu.
Künstlerisches Antikörperbild. KCH Natriumacetat3CO dient in der Produktion von Antikörpern in großen Mengen. Blitzkrieg1982 [CC BY-SA (https: // CreeveCommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.Obwohl Kaliumacetat (ACOK) das Zellwachstum hemmt oder versagt und die Zelldichte verringert, nimmt die Antikörperproduktivität für jede Zelle zu.
 Antikörperangriff auf einige Bakterien. SA1590 [CC BY-S (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.
Antikörperangriff auf einige Bakterien. SA1590 [CC BY-S (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons. In Antihielo -Mischungen
Kaliumacetat wurde in Antihielo -Gemischen verwendet (englische Übersetzung Anti-Icing) Um sie zu verwenden, um Straßen- und Zementgruppen zu schmelzen und so die sichere Verwendung dieser zuzulassen.
 Während der Winterstation sind die Straßen mit Schnee und Eis gefüllt. Kaliumacetat kann in solchen Fällen nützlich sein. Autor: s. Hermann & F. Richter. Quelle: Pixabay.
Während der Winterstation sind die Straßen mit Schnee und Eis gefüllt. Kaliumacetat kann in solchen Fällen nützlich sein. Autor: s. Hermann & F. Richter. Quelle: Pixabay. Die Kaliumacetat -Selektion (ACOK) für diese Anwendung ist auf eine 50% ige wässrige Lösung durch ACOK -Gewicht zurückzuführen und hat einen Fusionspunkt von -62 ° C. Das bedeutet, dass die Lösung selbst bei Temperaturen von nur -62 ° C geschmolzen bleibt.
Ein EUTTIC ist eine homogene Mischung aus Komponenten, die den geringsten Schmelzpunkt aller möglichen Gemische aufweist, einschließlich reiner Komponenten.
Wie es als Antihielo funktioniert
Kaliumacetat (ACOK) hat eine sehr gute Fähigkeit, das Eis zu schmelzen.
A -5 ° C kann für jede kg ACOK 11,5 kg Eis schmelzen. Diese Eigenschaft nimmt ab, indem die Temperatur verringert wird, aber sogar auf -50 ° C hat die Fähigkeit, 1,3 kg Eis für jeden kg ACOH zu schmelzen.
Können Sie dienen: Kristalline Feststoffe: Struktur, Eigenschaften, Typen, BeispieleA -5 ° C Diese Kapazität ist vergleichbar mit der von Natriumchlorid oder Tischsalz (NaCl), während von -30 ° C weit.
 Mit Kaliumacetat können Sie das Eis auf gefrorenen Straßen schmelzen. Autor: Markus Sch. Quelle: Pixabay.
Mit Kaliumacetat können Sie das Eis auf gefrorenen Straßen schmelzen. Autor: Markus Sch. Quelle: Pixabay. In den mit dem ACOK durchgeführten Tests zusammen mit anderen Verbindungen wurde jedoch ein gewisses Maß an Korrosion von Zementflächen beobachtet, so.
Andererseits die Kaliumacetatmischung (CH3Kochen) mit Kaliumformung (HCOK) ist ein ausgezeichnetes Antihielo und erfordert kein Antikorrosiv.
Verweise
- Baker, f.J. et al. (1976). Färbungsverfahren. Wässrige Bergbereitungen. In Einführung in die Medical Laboratory Technology (fünfte Ausgabe). Von Scientedirect erholt.com.
- Hassan, a.ZU. et al. (2018). Inzole: Synthese und bindungsbildende Heterocyclisierung. In Fortschritten in der heterocyclischen Chemie. Von Scientedirect erholt.com.
- ODER.S. Nationalbibliothek für Medizin. (2019). Kaliumacetat. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Das, a. und Alagirusamy, r. (2010). Feuchtigkeitsübertragung. Trockenmittel inverted Cup -Methode. In der Wissenschaft im Kleidungskomfort. Von Scientedirect erholt.com.
- Vargel, c. (2004). Carboxilsäuren und deren Derivate. Acetate. Bei Korrosion von Aluminium. Von Scientedirect erholt.com.
- Cuevas, j. (2014). Elektrophysiologische Aufzeichnungstechniken. Intrazelluläre Aufzeichnungstechniken. In Referenzmodulation in biomedizinischen Wissenschaften. Von Scientedirect erholt.com.
- Fink, j.K. (2018). Poly (Urethan) s. Recycling. Solvolyse. In reaktiven Polymeren: Grundlegende und Anwendungen (dritte Ausgabe). Von Scientedirect erholt.com.
- Fong, w. et al. (1997). Optimierung der monoklonalen Antikörperproduktion: Kombinierte Wirkungen von Kaliumacetat und Perfusion in einem gerührten Tank -Bioreaktor. Zytotechnologie 24: 47-54. Link wiederhergestellt.Springer.com.
- Danilov, v.P. et al. (2012). Low-Temperatur-Anti-Icing-Reagenzien in wässrigen Salzsystemen, die Acetate und Formen enthalten. Theoretische Grundlagen des Chemieingenieurwesens, 2012, Vol 46, Nr. 5, pp. 528-535. Link wiederhergestellt.Springer.com.
- Fakev, a.ZU.et al. (2012). Forschung und Entwicklung der Methode für Kaliumacetat mit hoher Reinheit. Journal of Applied Chemistry, 2012, vol. 85, nein.12, pp. 1807-1813. Link wiederhergestellt.Springer.com.
- « Magnetische Stoßeinheiten, Formeln, Berechnung, Beispiele
- Merkmale Eingabegeräte, Wie verwendet man, Typen, Beispiele, Beispiele »

