Natriumacetatstruktur, Eigenschaften, Synthese, verwendet

- 4244
- 572
- Lewis Holzner
Er Natriumacetat Es ist ein Natriumsalz aus Essigsäure, dessen molekulare Formel C ist2H3ENTWEDER2N / A. Es besteht aus einem weißen Pulver, das im Wesentlichen in zwei Formen vorhanden ist: wasserfrei und Trihydrat. Beide sind sehr löslich im Wasser, das universelle Lösungsmittel; Aber nicht so löslich in Alkoholen oder Aceton.
Die Anhydra -Form hat eine Dichte, eine Fusion und einen Siedepunkt mit höher. Dies liegt daran+ und Ch3Gurren-.
 Natriumacetat Aussehen
Natriumacetat Aussehen Natriumacetat ist stabil, insbesondere wenn es zwischen 2 und 8 ºC gelagert wird. Aber es ist anfällig für die Wirkung starker Oxidationsmittel und Halogene.
Es kann durch die Reaktion von Natriumbicarbonat mit Essigsäure hergestellt werden. Auch mit der Reaktion von Essigsäure mit Natriumhydroxid. Beide Reaktionen sind einfach zu erläutern und niedrige wirtschaftliche Kosten. Der erste kann sogar zu Hause gemacht werden.
Dieses Salz ist eine kleine giftige Verbindung. Erzeugt eine Reizung der Haut, erst nach einem häufigen und kontinuierlichen Kontakt. Es ist wenig irritierend für die Augen, kann aber die Atemwege reizen. Es gibt keine Informationen über eine schädliche Wirkung Ihrer Einnahme.
Es hat zahlreiche Verwendungen und Anwendungen, die seine pH -Dämpfungsfunktion zusammen mit Essigsäure hervorheben. Der Acetat -Stoßdämpfer hat einen PKA = 4,7; die eine hohe Effizienz bei der Regulierung des pH in einer sauren Umgebung mit pH -Werten zwischen 3 und 6 verleiht.
Aufgrund seiner geringen Toxizität und seiner Eigenschaften wurde es weit verbreitet, um den Geschmack von Nahrung zu verbessern, sowie ein Mittel, der aufgrund ihrer Maßnahmen gegen Mikroben Schutz vor ihrer Zersetzung bietet.
[TOC]
Natriumacetatstruktur
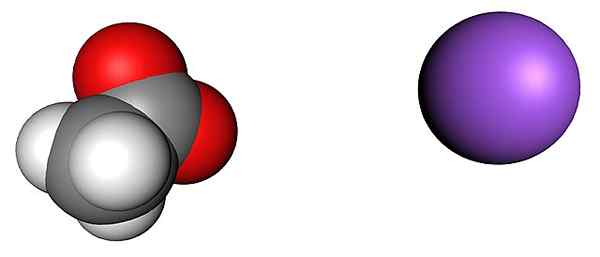 Acetat- und Natriumionen. Quelle: SHU0309 [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Acetat- und Natriumionen. Quelle: SHU0309 [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Das obere Bild zeigt die Ionen, aus denen die wasserfreien Natriumacetat -Kristalle (ohne Wasser) ausmachen. Die lila Kugel entspricht dem nationalen Kationen+, Und das molekulare Ion zu seiner Linken ist Acetat, Cho3Gurren-, Mit seinen Sauerstoffatomen, die durch rote Kugeln dargestellt werden.
Diese Kollegen zufolge dem Chip CH3Pfad befinden sich in einem Verhältnis von 1: 1; Für jede Cho3Gurren-, Es muss ein nationales Kationen geben+ Angezogen von seiner negativen Belastung und umgekehrt. Daher erstellen Attraktionen zwischen ihnen und Abstoßungen zwischen gleichen Lasten strukturelle Muster, die einen Kristall definieren, dessen minimale Expression die einheitliche Zelle ist.
Diese einheitliche Zelle variiert wie das Glas als Ganzes je nach Disposition der Ionen im Weltraum; Es ist nicht immer dasselbe, selbst für dasselbe kristalline System. Beispielsweise kann wasserfreies Natriumacetat zwei ortorrombische Polymorphe bilden, von denen eine unten dargestellt wird:
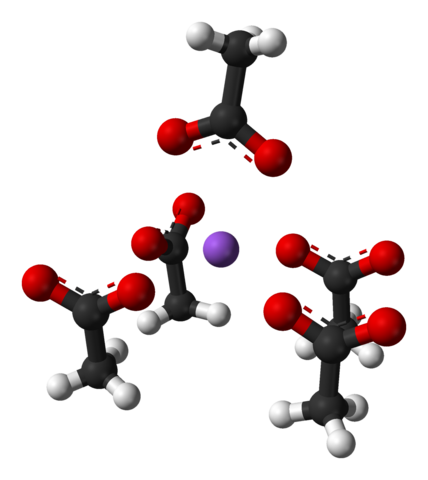 Einheitszelle von Natriumacetat -orthorrombischen Kristallen. Quelle: Benjah-BMM27 [Public Domain]
Einheitszelle von Natriumacetat -orthorrombischen Kristallen. Quelle: Benjah-BMM27 [Public Domain] Beachten Sie die Anordnung der Ionen: vier Cho -Ionen3Gurren- Sie schließen eine NA ein+ so, dass sie eine verzerrte Quadratbasis -Pyramide "zeichnen". Jeder dieser Cho3Gurren- Interagieren wiederum mit einer anderen NA+ benachbart.
Hydratisierte Kristalle
Natriumacetat hat viel Affinität zu Wasser; In der Tat ist es köstlich, das heißt, es behält Feuchtigkeit zurück, bis es sich in demselben aufgelöst hat. Je größer die Feuchtigkeit, und früher ist es "schmilzt". Das liegt daran, dass so so3Gurren- Wie na+ Sie können mit Wassermolekülen, die ihre Dipole zu ihren Lasten führen+ Oh2, CH3Gurren- Hoh).
Kann Ihnen dienen: Silberbromid (AGBR): Struktur, Eigenschaften und VerwendungWenn dieses Salz im Labor oder zu Hause zubereitet wird, ist es eine solche Affinität zu Wasser, dass selbst bei normalen Temperaturen bereits als Hydrat erhalten wird. das CH3Pata · 3h2ENTWEDER. Ihre Kristalle hören auf, ortorrombisch zu sein und monoklin zu werden, da sie jetzt drei Wassermoleküle für jedes Paar Cho enthalten3Gurren- und na+.
Eigenschaften
Namen
-Natriumacetat.
-Natriumethanoat (IUPAC).
Molmasse
-Wasserfrei: 82,03 g/mol.
-Trihydratisiert: 136,03 g/mol.
Aspekt
Zartes weißes Pulver.
Geruch
Zum Essig, wenn er zur Zersetzung erhitzt wird.
Dichte
-Anhidro: 1, 528 g/cm3 bei 20 ºC.
-Trihydratisiert: 1,45 g/cm3 bei 20 ºC.
Schmelzpunkt
-Anhidro: 324 ºC (615 ºF, 597 K).
-Triohydrat: 58 ºC (136 ºF, 331 K).
Siedepunkt
-Anhidro: 881,4 ºC (1.618,5 ºF, 1.154,5 K).
-Trihydrat: 122 ºC (252 ºF, 395 K). Es zersetzt sich.
Löslichkeit
Im Wasser
-Anhydro: 123,3 g/100 ml bei 20ºC.
-Trihydratisiert: 46,4 g/100 ml bei 20 ºC.
In Methanol
16 g/100 g bei 15 ºC.
In Ethanol
5,3 g/100 ml (Trihydrat).
In Aceton
0,5 g/kg bei 15 ° C.
Säure
PKA: 24 (20 ºC).
Basizität
PKB: 9,25. Hier ist offensichtlich, dass Natriumacetat ein Basissalz ist, um PKB weniger als seine PKA zu haben.
Brechungsindex (ηd)
1.464
Kalorienkapazität
-100,83 j/mol · k (wasserfrei).
-229.9 J/Mol · k (Trihydrado).
Zündungspunkt
Über 250 ° C.
Self -Anmut -Temperatur
600 ºC.
pH
8,9 (Lösung 0,1 m bis 25 ºC).
Stabilität
Stabil. Unvereinbar mit starken und Halogenoxidationsmitteln. Feuchtigkeit.
Reaktionen
Natriumacetat kann ein Ester bilden, indem sie mit einem Miden -Halogenid reagiert. Zum Beispiel Bromoetano:
CH3Poron +Brch2CH3 => Ch3Cooch2CH3 + Nabr
Natriumacetat ist Decarboxyla zur Bildung von Methan (Pyrolyse) in Gegenwart von NaOH:
CH3Poon +NaOH => ch4 + N / A2CO3
Die Reaktion wird durch Cesio -Verkauf katalysiert.
Synthese
Natriumacetat kann im Labor zu niedrigen Kosten hergestellt werden, indem Natriumbicarbonat mit Essigsäure reagiert wird:
Nahco3 + CH3Cooh => ch3Pfad +h2CO3
Diese Reaktion wird aufgrund der Zersetzung von Kohlensäure in Wasser und Kohlendioxid von der Anwesenheit in der Lösung einer intensiven Blase begleitet.
H2CO3 => H2Oder +co2
Industriell wird Natriumacetat durch Reaktion von Essigsäure mit Natriumhydroxid produziert.
CH3COOH +NAOH => CH3Pfad +h2ENTWEDER
Anwendungen
Wärmeleitbeutel
Natriumacetat wird zur Herstellung von Wärmebeuteln verwendet.
Anfänglich werden Salzkristalle in einem Wasservolumen zur Herstellung einer Lösung gelöst, die übersättigt wird.
Dann ist die Lösung von einer Temperatur von mehr als 58 ° C erhitzt, was der Schmelzpunkt ist. Die übersättigte Lösung bei Raumtemperatur ist abzukühlen und die Bildung von Kristallen wird nicht beobachtet; Die Lösung ist über -chirp.
Kann Ihnen dienen: Periodenzüchter, wofür ist esEs wird erklärt. Die Flüssigkeit befindet sich in einem metastabilen Zustand, einem Ungleichgewichtszustand.
Geben. Bei Wärmebeuteln wird ein mechanischer Befestigung gepresst, um die Flüssigkeit zu rühren und die Bildung von Kristallen und die Verfestigung der trihydratisierten Natriumacetatlösung zu initiieren.
Wenn die Kristallisation auftritt, nimmt die Temperatur zu. Trihydratisierte Natriumacetat -Kristalle erwerben das Eis aus, aber sie sind heiß, so wird es "heißes Eis" genannt.
Industrielle
-Natriumacetat wird in der Textilindustrie als Unterricht im Gewebefärbungsprozess verwendet
-Schwefelsäureabfälle neutralisieren
-Es wird in der Baumwollverarbeitung zur Ausarbeitung von Baumwollpolstern verwendet, die für die persönliche Reinigung und für medizinische Zwecke verwendet werden können
-Es wird vor seinem Chrom bei Metallfickling verwendet
-Arbeitet so zusammen, dass die Vulkanisierung von Chloropren im synthetischen Gummiproduktionsprozess nicht auftritt
-Eingriffen in die Reinigung von Glukose
-Es wird beim Bräunen mit Skins verwendet.
Medizinischer Gebrauch
Natriumacetat ist Teil der Verbindungen, die zur Versorgung von Elektrolyten, die intravenös Patienten verabreicht werden.
Es wird verwendet, um die Natriumspiegel bei hyponathämischen Patienten zu korrigieren, auch bei der Korrektur von metabolischer Azidose und Urinalkalinierung.
PH -Dämpfungslösung
Es wird als pH -Regulator in vielen enzymatischen Reaktionen verwendet, die zwischen pH 3 und pH 6 auftreten.
Der unterschiedliche pH -Wert der Acetatpufferlösung wird durch die Variation der Konzentration von Essigsäure und Natriumacetat erreicht.
Um beispielsweise einen pH -Wert von 4.5 zu erhalten.
Die Konzentration der Acetatpufferlösung kann erhöht werden und erhöht sich im gleichen Anteil der Komponenten der erforderlichen Lösung, um den gewünschten pH zu erhalten.
Acetat/Acetonitril -Stoßdämpfer wird bei der Kapillarelektrophorese bei der Photoberberin -Trennung verwendet.
Forschungslabors
-Natriumacetat ist ein schwaches nukleophiles Mittel, das bei der anionischen Polymerisation von β-Lacton verwendet wird.
-Es wird als Reagenz in der nuklearen Magnetresonanz biologischer Makromoleküle verwendet.
-Es wird bei der Extraktion der Zellen der Zellen verwendet. Natrium ist ein Kation, das mit den in der DNA vorhandenen negativen Phosphaten interagiert, was in seiner Kondensation hilft. In Gegenwart von Ethanol bildet die DNA einen Niederschlag, der dann in die wässrige Schicht getrennt werden kann.
Lebensmittelschutz
-Es hilft dabei.
-Das in Acetat vorhandene Natrium verstärkt den Geschmack von Lebensmitteln.
-Natriumacetat wird zur Herstellung von Gemüsegurken verwendet: Gurke, Karotte, Zwiebel usw. Darüber hinaus wird es im Fleischschutz verwendet.
Kann Ihnen dienen: Dimethylanylin: Struktur, Eigenschaften, Synthese, verwendetErhaltung von Beton
Der Beton wird durch die Wirkung von Wasser beschädigt, die seine Dauer verkürzt. Natriumacetat fungiert als Betonversiegelungsmittel, das es in Wasser wasserdicht und seine anfänglichen Eigenschaften verlängert.
Junge Experimente
Experiment 1
Ein einfaches Experiment ist die Natriumacetat -Synthese durch die Natriumbicarbonat -Reaktion mit Essig (5%Essigsäure).
30 ml Essig werden in einem Becherer platziert und ungefähr 3,5 g Bicarbonat werden zugegeben.
In der Reaktion bildet sich Natrium- und Kohlensäurebildflächen. Säure wird in Kohlendioxid und Wasser zerlegt. Die Erzeugung von Kohlendioxid erzeugt eine intensive Blase innerhalb der Lösung.
Um Natriumacetat zu sammeln, wird die Wasserverdunstung verursacht, die Lösung erhitzt.
Experiment 2
Ein weiteres einfaches Experiment ist die Bildung von Natrium -Trihydratacetat.
Dazu etwa 20 g Natriumacetat -Trihydrat und in einen Becherchen gelegt, dann 10 ml Wasser hinzufügen und dann 10 ml Wasser hinzufügen. Die Lösung wird auf eine Temperatur von mehr als 58 ° C erhitzt.
Natriumacetat ist vollständig gelöst, um sicherzustellen, dass die Lösung übersättigt ist. Zuvor wird eine Pietri -Kapsel auf eine kalte Oberfläche platziert.
Der Gehalt des Becherers mit Trihydratacetat in Pietris Kapsel wird langsam gegossen. Die Flüssigkeitstemperatur in der Kapsel beginnt selbst unter dem Schmelzpunkt abzusteigen, ohne die Kristallisation oder Verfestigung des Trihydrat -Natriumacetat zu beobachten.
Um die Kristallisation von trihydratisiertem Natriumacetat zu erzeugen, wird eine kleine Menge Salz hinzugefügt, um als Kristallisationskern zu dienen. In anderen Fällen gibt es eine geringe Störung der Lösung, um die Kristallisation von Natriumacetat zu initiieren.
Die trihydrierten Natriumacetatkristalle sehen aus wie das Eis, aber wenn sie berührt werden, wird festgestellt, dass sie relativ heiß sind. Aus diesem Grund heißt Salz "heißes Eis".
Toxizität
Natriumacetat ist eine sehr kleine giftige Verbindung. Es wird auch nicht als Sensibilisator für Haut und Atemwege eingestuft.
Darüber hinaus wird Natriumacetat nicht als mutagener Mittel in Keim-, Karzinogen- oder Giftzellen für die Reproduktion klassifiziert.
Kurz gesagt, es ist wenig irritierend für die Augen. Die Atemwege können nach ihrem Einatmen irritiert werden. Häufiger und ständiger Kontakt mit der Haut kann zu seiner Reizung führen.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Worldofchemicals. (16. Januar 2017). Wie man Natriumacetat zu Hause vorbereitet? Erholt von: Medium.com
- Nationales Zentrum für Biotechnologie Information. (2019). Natriumacetat. Pubchem -Datenbank. CID = 517045. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- S. Cameron, k. M. Mannan und m. ENTWEDER. Rahman. (1976). Die Kristallstruktur von Natriumacetat -Trihydrat. Kristallat. B32, 87.
- Wikipedia. (2019). Natriumacetat. Abgerufen von: in.Wikipedia.Org
- Helmestine, Anne Marie, ph.D. (24. Januar 2019). Machen Sie heißes Eis aus Essig und Backpulver. Erholt von: thoughtco.com
- Chemisches Buch. (2017). Natriumacetat. Erholt von: Chemicalbook.com
- Wasserman Robin. (2019). Verwendung von Natriumacetat. Erholt von: Livestrong.com
- Drogenbank. (2019). Natriumacetat. Erholt von: Drugbank.AC

