Acetylcholinesterase -Struktur, Funktionen und Inhibitoren
- 3255
- 113
- Lewis Holzner
Der Acetylcholinesterase (Acetylcholin Acetyla hydrolesen, EC 3.1.1.7) Es ist ein Enzym, das sich hauptsächlich im Zentralnervensystem befindet. Wie der Name schon sagt, ist seine Aufgabe die hydrolytische Verarbeitung des Acetylcholin -Neurotransmitters.
Es ist ein mit der Zellmembran assoziiertes Enzym, das zusammen mit dem Acetylcholin -Empfänger zusammenarbeitet.
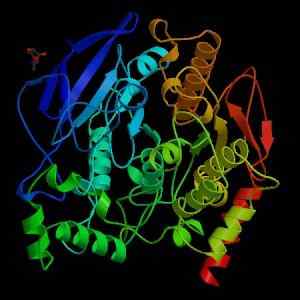
 Acetylcholinesterase -Struktur (Quelle: Wikimedia Commons)
Acetylcholinesterase -Struktur (Quelle: Wikimedia Commons) Aus mechanischer Sicht kann dieses Enzym als Serin-Hydrolase angesehen werden und enthält in der katalytischen Domäne des aktiven Zentrums die Triade von Aminosäuren, die für die Proteasen charakteristisch sind: Serin, Histidin und einen Säurerrest. Der saure Rückstand ist jedoch ein Glutamat, während Proteasen normalerweise ein Aspartat haben.
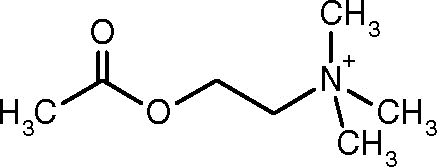 Acetylcholinstruktur (Quelle: AlineBoom [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Acetylcholinstruktur (Quelle: AlineBoom [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Eine der ersten Beobachtungen, die die katalytische Aktivität von Acetylcholinesterase mit cholinergen Nervengeweben und Muskelgeweben in Verbindung brachten, war, dass Dale 1914 hergestellt wurde. Anschließend wurde festgestellt, dass es auch in nicht-kollorischen Neuronen und in hämatopoetischen, osteogenen und neoplastischen Zellen vorhanden ist.
Dank der Untersuchung verschiedener Organismen ist derzeit bekannt, dass Enzym in der Membran verschiedener Arten von Zellen wie Erythrozyten, Nerven- und Muskelzellen, elektrischen Organen und anderen vorhanden ist.
[TOC]
Struktur
Tertiär- und Quartärstruktur
Unter natürlichen Bedingungen oder "in vivo ", Acetylcholinesterase ist ein polymorphes Enzym, das aus mehreren katalytischen Untereinheiten von mehr oder weniger 80 kDa besteht, die zu einer oligomeren Struktur (von mehreren Untereinheiten) zusammengestellt werden,.
Die Menge und Komplexität dieser Untereinheiten hängt vom Zelltyp und den Arten ab, die berücksichtigt werden.
Einige der komplexesten enzymatischsten Formen haben katalytische Untereinheiten mit kugelförmigen Formen (g) oder asymmetrisch (a), die durch Disulfidbrücken verbunden sind. Die Disulfidbrücken sind kovalent.
Jedes Untereindexus G enthält ein einzelnes aktives Zentrum, während die Untereinheiten A normalerweise durch die Präsentation von drei Strukturdomänen charakterisiert sind, nämlich: katalytische Untereinheiten, Kollagenschwänze reich an Glycin, Hydroxiprolin und Hydroxilisinabfällen und anderen nicht kollagenen Schwänzen (unterschiedlich von Kollagen unterscheiden).
Asymmetrische Formen von Acetylcholinesterase sind als A12, A8 und A4 bekannt, die 12, 8 bzw. 4 katalytische Untereinheiten haben.
Kann Ihnen dienen: Flora und Fauna aus Afrika: repräsentative ArtenIm Allgemeinen befinden sich die Reste der katalytischen Domäne im aktiven Zentrum in einer „tiefen“ Region der Untereinheiten, die als widersprüchlich in Bezug auf die schnelle Geschwindigkeit der Reaktion angesehen werden können Diese Websites.
Unabhängig vom Enzympolymorphismus haben sowohl globuläre als auch asymmetrische Untereinheiten ähnliche katalytische Aktivitäten.
Varianten
Einige andere Zellen als Nervenzellen, da Erythrozyten überwiegend globuläre, dimetrische und meist assoziierte Acetylcholinestenzyme mit der Außenfläche der Plasmamembran produzieren.
Das Enzym von Erythrozyten ist zwar von weniger struktureller Komplexität, aber auch ein amphipatisches Enzym, dessen aktive katalytische Domäne in der großen hydrophilen Region vorkommt, während hydrophobe Domäne, die die terminale Carboxylregion enthält.
Primärstruktur
Ein Großteil des aktuellen Wissens über die Acetylcholinesterase -Sequenz ergab sich aus der Untersuchung des Enzyms Kalifornica Torpedo, Ein Linienfisch, der im Pazifik lebt und traditionell als Modellorganismus für die Untersuchung verschiedener Nervensystemproteine verwendet wurde.
Die Untereinheiten von Acetylcholinesterase werden als Pro-Proteine synthetisiert, die dann verarbeitet werden, um reife Untereinheiten zu erzeugen. Jede Untereinheit besteht aus einem Polypeptid von etwa 575 Aminosäuren und 65 kDa-Molekulargewicht, was durch Zugabe von 7-8% Kohlenhydratabfällen (Glykosylierung) zunimmt.
Die katalytische Aktivität des aktiven Zentrums der Untereinheiten wird durch einen Serinrest in der 200 -Position bestimmt, der sich in einer „tiefen“ Region der katalytischen Untereinheiten befindet.
In Organismen existieren verschiedene Varianten oder Isoformen des Enzyms dank verschiedener Orte für die "alternatives Spleißen " der Vorn-Boten an beiden Enden (5 'und 3'). Die Carboxyl-terminale Sequenz der Isoform jeder Untereinheit ist diejenige, die die Montage der Oligomere miteinander bestimmt.
Funktionen
Acetylcholinesterase ist ein Enzym mit mehreren biologischen Funktionen, die nicht unbedingt miteinander verbunden sind. Durch seine unterschiedliche Expression während der Embryogenese, der embryonalen Neuralerweiterung, der Muskelentwicklung und der Synptogenese bestätigt.
Wie zuvor betont, hat es eine wichtige Funktion bei der schnellen Hydrolyse von Acetylcholin und damit bei der Regulation seiner Wirkung auf den neuromuskulären synaptischen Raum oder in den collorischen synaptischen Räumen des Zentralnervensystems des Zentralnervensystems.
Es kann Ihnen dienen: Biologieanwendungen im ViehzuchtEin Beispiel für seine Funktionen ist die Kontraktion des Skelettmuskels, der dank einer Art chemischer Synapse auftritt.
In dieser Synapse werden Hunderte von mit Acetylcholin beladenen Vesikeln erreicht, die aus dem Motoneuron zur Ausbreitung eines elektrischen Impulses freigesetzt werden.
Dieser Neurotransmissionsprozess ist recht komplex, aber die Beteiligung der Acetylcholinesterase ist entscheidend für die Beendigung der synaptischen Übertragung, die vom Acetylcholin -Neurotransmitter abhängt.
Somit ist das Acetylcholinesterase -Enzym für die Regulierung der Konzentration dieses Senders in der Neuromotora -Synapse verantwortlich.
Andere „nicht klassische“ Funktionen des Enzyms hängen mit der Neuritogenese oder dem Wachstum von Nervenzellen zusammen; Mit Zelladhäsionsprozessen, Synaptogenese, Aktivierung von Neuronen-Dopamin in der schwarzen Substanz des Mittelhirns, der hämatopoetischen Prozesse und der Thrombus poetisch.
Inhibitoren
Acetylcholinesterase -Inhibitoren, die zu Acetylcholin hydrolysiert werden, wodurch das Niveau und die Dauer der Wirkung dieses Neurotransmitters erhöht wird. Sie können nach ihrem Wirkungsmechanismus als reversibel und irreversibel eingestuft werden.
Irreversible Inhibitoren
Sie sind solche, die die hydrolytische Aktivität von Acetylcholinesterase aufgrund ihres kovalenten Übergangs zum Serinrest am aktiven Zentrum des Enzyms irreversibel hemmen. Diese Gruppe besteht hauptsächlich aus Organophosphat.
Im Allgemeinen sind dies aktiv. Sie sind Ester oder Thiolen, die aus phosphorischen, phosphonischen, phosphin oder phosphoramídico -Säure stammen.
Sarin, Tabun, Soman und Cyclosarin gehören zu den giftigsten Verbindungen, die vom Menschen synthetisiert wurden, da sie einen Menschen töten können.
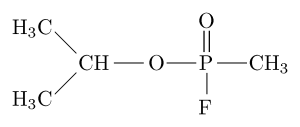 Molekulare Struktur des Organophosphat -Inhibitors „Sarín“ (Quelle: Sivizius [Public Domain] über Wikimedia Commons)
Molekulare Struktur des Organophosphat -Inhibitors „Sarín“ (Quelle: Sivizius [Public Domain] über Wikimedia Commons) Sarin zum Beispiel ist ein "Nervenzas", das als chemische Waffe für den Gebrauch von Terroristen verwendet wurde.
Reversible Inhibitoren
Diese Reihenfolge der Klassifizierungsgruppen, die wettbewerbsfähige und nicht -kompetitive Inhibitoren, die durch vorübergehende und reversible Carbamylierung eines Serinrestes auf dem aktiven Zentrum arbeiten, wurden synthetisiert und aus Anlagen- oder Pilzquellen gereinigt.
Kann Ihnen dienen: Sokes: Eigenschaften, Struktur, FunktionenCarbamate wie Physostigmin und Neostigmin sind reversible Inhibitoren, die als Arzneimittel zur Behandlung von Krankheiten wie Glaukom bzw. Miastinia gravis eingesetzt werden.
Andere therapeutische Wirkstoffe dieser Gruppe werden ebenfalls zur Behandlung von Alzheimer-Krankheit, Parkinson-Parkinson, postoperativ.
Butirilcolinesterase
Ein interessanter natürlicher Mechanismus gegen einige inhibitorische Substanzen von Acetylcholinesterase hat mit der Teilnahme eines weniger spezifischen Enzyms zu tun, das als Butirilcolinesterase bekannt ist.
Dieses Enzym kann auch hydrolysieren.
Acetylcholinesterase und Alzheimer -Krankheit
Es wurde gezeigt, dass Acetylcholinesterase einen stabilen Komplex mit den Komponenten der Senile -Eigenschaften der Pathologie bildet. Darüber hinaus haben sich einige veränderte Glykosylierungsmuster dieses Enzyms mit der Vorhandensein und Bildung von Amyloidplaques im Gehirn zusammenhängen.
Viele der reversiblen Inhibitoren von Acetylcholinesterase wurden daher als Medikamente der ersten Generation zur Behandlung dieser Krankheit und anderer verwandter neurodegenerativer Erkrankungen verwendet. Unter ihnen sind Donepezilo, Rivastigmina und Galantamin.
Verweise
- Dvir, h., Silman, ich., Harel, m., Rosenberry, t. L., & Sussman, j. L. (2010). Acetylcholinesterase: Von der 3D -Struktur zur Funktion. Chemisch-biologische Wechselwirkungen, 187, 10-22.
- Houghton, p., Ren und., & Howes, m. (2006). Acetylcholinesterase -Inhibitoren aus Pflanzen und Pilzen. Naturproduktberichte, 23, 181-199.
- Krsti, d. Z., Lazarevi, t. D., Bond, a. M., & Vasi, v. M. (2013). Acetylcholinesterase -Inhibitoren: Pharmakologie und Toxikologie. Aktuelle Neuropharmazie, elf, 315-335.
- Mukherjee, p. K., Kumar, v., Schlecht, m., & Houchton, p. J. (2007). Acetylcholinesterase -Inhibitoren aus Pflanzen. Phytomedizin, 14, 289-300.
- Quinn, d. M. (1987). Acetylcholinesterase: Enzymstruktur, Reaktionsdynamik und virtuelle Übergangszustände. Chem. Rev., 87, 955-979.
- Racchi, m., Mazzucchelli, m., Porrello, e., Lanni, c., & Govoni, s. (2004). Acetylcholinesterase -Inhibitoren: Neue Aktivitäten alter Molecles. Pharmakologische Forschung, fünfzig, 441-451.
- Rosenberry, t. (1975). Acetylcholinesterase. Fortschritte in der Enzymologie und verwandten Bereichen der molekularen Biologie, 43, 103-218.
- Soreq, h., & Seidman, s. (2001). Acetylcholinesterase - Neue Rollen für einen alten Schauspieler. Nature Reviews, 2, 294-302.
- Geschichten, v. N. (2001). Acetylcholinesterase bei Alzheimer -Krankheit. Mechanismen des Alterns und der Entwicklung, 122, 1961-1969.

