Aktineigenschaften, Struktur, Filamente, Funktion
- 1054
- 0
- Joy Hort
Der Aktin Es ist ein zytosolisches Protein, das Mikrofilamente bildet. In Eukaryoten ist Actin einer der am häufigsten vorkommenden Proteine. Zum Beispiel entspricht es 10% nach Gewicht des Gesamtproteins in Muskelzellen; und zwischen 1 und 5% des Proteins in Nicht -Muskelzellen.
Dieses Protein neben den Zwischenfilamenten und Mikrotubuli bildet das Zytoskelett, dessen Hauptfunktion die Mobilität der Zelle, die Aufrechterhaltung der Zellform, die Zellteilung und die Bewegung von Organellen in Pflanzen, Pilzen und Tieren ist.
 Quelle: Sarkomere.SVG: David Richfield (Slashme-User) Derivatarbeit: Retama [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]
Quelle: Sarkomere.SVG: David Richfield (Slashme-User) Derivatarbeit: Retama [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]] Isoformen des Aktin -Zytoskeletts.
Aus evolutionärer Sicht ist Actin ein hoch erhaltenes Protein. Es gibt ungefähr 90% Sequenzhomologie bei verschiedenen Arten. In einzelligen Organismen kodiert ein einzelnes Gen für eine Aktin IsaForm. In mehrzelligen Organismen codieren verschiedene Gene mehrere Aktin -IsaForms.
Das Actin war zusammen mit Myosin entscheidende Strukturen in der evolutionären Zukunft eukaryotischer Organismen und ihrer Diversifizierung, da sie die Bewegung in Abwesenheit anderer Strukturen wie Flagella und Zilien erlaubten.
[TOC]
Struktur: Aktinfilamente
Actin ist ein einzelnes globuläres Protein der Polypeptidkette. Im Muskel hat das Actin eine molekulare Masse von ungefähr 42 kDa.
Dieses Protein hat zwei Domänen. Jeder hat zwei Subdomains und eine Spalte zwischen den Domänen. Der ATP-Mg+2 schließt sich am Boden der Spalte an. Die Amino- und Carboxil -Terminals kommen in Subdomain 1 zusammen.
Actina G und Actina F
Es gibt zwei Hauptaktinformen: das Actin Monomer, Actina G genannt; und ein filamentöses Polymer, das aus Actin G -Monomeren besteht, die Actina f bezeichnet wird. Actin -Filamente, die durch elektronische Mikroskopie beobachtet werden, haben enge bzw. breite Regionen, 7 nm bzw. 9 nm Durchmesser.
Im gesamten Filament bildet Actin Monomere eine doppelte Helix, die gepresst. Eine Einheit, die im gesamten Filament wiederholt wird.
Das Actin -Filament hat zwei Enden. Man bildet den Spalt, der ATP-Mg verbindet+2, die sich in allen Aktinmonomeren des Filaments in derselben Richtung befindet, das Ende (-) bezeichnet wird; Und das andere Ende ist das Gegenteil, das Ende genannt (+). Daher wird gesagt, dass das Actin -Filament Polarität hat.
Oft werden diese Komponenten als Mikrofilamente bezeichnet, da sie die Komponenten des Zytoskeletts sind, die weniger Durchmesser aufweisen.
Wo finden wir Actin?
Actin ist ein äußerst häufiges Protein in eukaryotischen Organismen. Actin von allen Zellproteinen entspricht etwa 5 bis 10% - je nach Zelltyp. In der Leber beispielsweise jede der Zellen, die sie ausmachen, hat fast 5.108 Aktinmoleküle.
Eigenschaften
Die beiden Formen von Actin, Monomer und Filament sind ständig in einem dynamischen Gleichgewicht zwischen Polymerisation und Depolymeren zu finden. Im Allgemeinen gibt es drei Merkmale dieses Phänomens:
1) Aktinfilamente sind typisch für die Struktur des Muskelgewebes und des Zytoskeletts eukaryotischer Zellen.
Kann Ihnen dienen: Die 10 Merkmale der herausragendsten Lipide2) Polymerisation und Depolimerisierung ist ein dynamischer Prozess, der reguliert wird. Wo die Polymerisation oder Aggregation von G-ATP-Mg-Actin-Monomeren+2 Es passiert an beiden Enden. Dass dieser Prozess auftritt.
3) Die Bildung von Strahlen und Retikeln, aus denen das Aktin -Zytoskelett besteht, verleiht der Zellmotilität Kraft. Dies hängt von Proteinen ab, die an der Bildung von Querbindungen beteiligt sind.
Funktionen
Muskelkontraktion
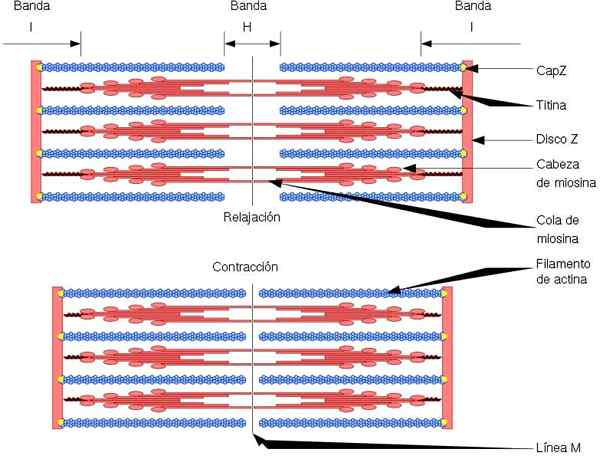
Die funktionelle und strukturelle Einheit des Skelettmuskels ist der Sarkoman, der zwei Arten von Filamenten hat: dünne Filamente, die durch Actin gebildet werden, und dicke Filamente, die durch Myosin gebildet werden. Beide Filamente sind abwechselnd auf genaue geometrische Weise organisiert. Muskelkontraktion zulassen.
Dünne Filamente sind in Regionen, die als Discs Z bezeichnet werden, verankert. Diese Region besteht aus einem Fasernetzwerk, in dem sich das CAPZ -Protein befindet und an dem die Enden (+) der Aktinfilamente verankert sind. Dieser Anker verhindert die Endablagerung (+).
Andererseits befindet sich an den Enden (-) von Aktinfilamenten Tropomodulin und schützt sie vor Depolymersion. Zusätzlich zu Actin haben dünne Filamente Tropomiosin und Troponin, die die Funktion der Kontrolle von Actomiosin -Wechselwirkungen haben.
Wie tritt Muskelkontraktion auf??
Während der Muskelkontraktion machen dicke Filamente Drehbewegungen und ziehen die dünnen Filamente in die Mitte des Sarkomers. Dies erzeugt das Gleiten der dicken und dünnen Fasern.
Somit bleibt die Länge der dicken und dünnen Filamente konstant, erhöht jedoch die Überlappung zwischen beiden Filamenten. Die Länge des Sarkomers nimmt durch die Verankerung dünner Filamente an den Z -CDs ab.
Wie hört die Muskelkontraktion auf??
ATP ist die Energiewährung der Zelle. Daher ist es fast immer in lebenden Muskelgeweben verfügbar. Unter Berücksichtigung der oben genannten müssen es Mechanismen geben, die Muskelentspannung und die Verhaftung von Kontraktionen ermöglichen.
Zwei Proteine, Tropomiosin und Troponin genannt, spielen in diesem Phänomen eine grundlegende Rolle. Diese arbeiten zusammen, um die Gewerkschaftsstellen von Myosin zu blockieren (so verhindern Sie ihre Vereinigung mit Actin). Infolgedessen entspannt sich der Muskel.
Im Gegensatz dazu erlebt ein Tier ein Phänomen, das als Mortis -Strenge bekannt ist. Die Person, die für diese Verhärtung des Körpers verantwortlich ist, ist die Blockade der Wechselwirkung zwischen Myosin und Actin, kurz nach dem Tod des Tieres.
Eine der Folgen dieses Phänomens ist die Notwendigkeit von ATP für die Freisetzung der beiden Proteinmoleküle. Logischerweise gibt es keine ATP -Verfügbarkeit in toten Stoffen, und diese Veröffentlichung kann nicht auftreten.
Andere Bewegungsarten
Der gleiche Mechanismus, den wir beschreiben (später werden wir den Mechanismus vertiefen, der der Bewegung zugrunde liegt) ist nicht auf die Muskelkontraktionen von Tieren beschränkt. Er ist verantwortlich für die Ameboidalbewegungen, die wir in den Amöben und in einigen Kolonialformen beobachten.
Ebenso wird die zytoplasmatische Bewegung, die wir in Algen und Landpflanzen beobachten, von ähnlichen Mechanismen geführt.
Regulation der Polymerisation und Depolymerisation des Aktinfilaments
Die Kontraktion des glatten Muskelgewebes und der Zellen erzeugt eine Aktin -F -Zunahme und eine Abnahme der Aktin G. Die Aktinpolymerisation erfolgt in drei Stadien: 1) Keimbildung, ein langsamer Schritt; 2) Dehnung, ein kurzer Schritt; und 3) stabiler Status. Die Polymerisationsgeschwindigkeit entspricht der Depolymerisationsrate.
Kann Ihnen dienen: Fixist -Theorie: Konzept, Postulate und AutorenDas Aktinfilament wächst am Ende (+) schneller als am Ende (-). Die Dehnungsgeschwindigkeit ist proportional zur Konzentration von Aktinmonomeren im Gleichgewicht mit Aktinfilamenten, die als kritische Konzentration (CC) bezeichnet werden (CC).
Der CC für das Ende (+) beträgt 0,1 µm und für das Ende (-) 0,8 µm. Dies bedeutet, dass 8 -mal weniger Konzentration von Aktinmonomeren erforderlich ist, um das Ende zu polymerisieren (+).
Die Aktinpolymerisation wird hauptsächlich durch Beta4 -Betrug (TB4) reguliert. Dieses Protein verbindet das Handeln und behält es bei, die Polymers verhindert. Während Propylin die Aktinpolymerisation stimuliert. Profil bindet an Aktinmonomere, die die Polymerisation am Ende (+) durch Dissoziation des Actin-TB4-Komplexes erleichtern.
Andere Faktoren wie Ionenerhöhung (NA+, K+ oder mg+2) Die Bildung von Filamenten bevorzugen.
Aktin -Zytoskelettbildung
Die Bildung des Aktin -Zytoskeletts erfordert die Ausarbeitung von Querbindungen zwischen Aktinfilamenten. Diese Links bilden Proteine, deren Highlights: Sie haben Domänen der Vereinigung zu Actin; Viele haben homologe Domänen nach Calponine; und jede Art von Protein wird in einer bestimmten Art von Zelle exprimiert.
In Philopoden und Stressfasern werden Kreuzbindungen zwischen Aktinfilamenten von Fascin und Philamine hergestellt. Diese Proteine machen Aktinfilamente parallel oder haben unterschiedliche Winkel. Daher definieren Aktinfilamente die Form der Zelle.
Die Zellregion mit der höchsten Menge an Aktinfilamenten befindet sich in der Nähe der Plasmamembran. Diese Region heißt Kortex. Das kortikale Zytoskelett ist abhängig vom Zelltyp in verschiedenen Formen organisiert und verbindet durch Fixierproteine mit der Plasmamembran.
Einige der am besten beschriebenen Zytoskelette sind Muskelzellen, Blutplättchen, Epithelzellen und Erythrozyten. Zum Beispiel verbindet das Dystrophin -Fixierprotein in muskulären Zellen Actin -Filamente zu einem umfassenden Glykoprotischen Komplex der Membran. Dieser Komplex bindet an extrazelluläre Matrixproteine.
Actin-Miosin-Interaktionsmodell
Rayment -geführte Forscher schlugen ein Vier -Stufe -Modell vor, um die Wechselwirkung von Actin und Myosin zu erklären. Der erste Schritt tritt bei der Vereinigung von ATP zu Myosin -Köpfen auf. Diese Vereinigung erzeugt eine Konformationsänderung des Proteins und setzt sie von Actin im kleinen Filament frei.
Dann wird der ATP auf ADP hydrolysiert und ein anorganisches Phosphat freigibt. Das Myosinmolekül ist an einer neuen Aktin -Untereinheit verankert, wodurch ein hoher Energiezustand erzeugt wird.
Die Freisetzung von anorganischem Phosphat bringt eine Änderung des Myosins mit sich, die zur anfänglichen Konformation und die Bewegung der kleinen Filamente in Bezug auf die dicken Filamente in Bezug auf die dicken Filamente zurückkehrt. Diese Bewegung bewirkt die Bewegung der beiden Enden des Sarkomers und nähert sich ihnen.
Der letzte Schritt beinhaltet die Freisetzung von ADP. Zu diesem Zeitpunkt ist der Kopf von Myosin kostenlos und kann sich einem neuen ATP -Molekül anschließen.
Es kann Ihnen dienen: Biologie: Geschichte, welche Studien, Zweige, BasenZellbewegung durch Aktinpolymerisation
Rektormotilität ist eine Art Zellmotilität. Die Schritte dieser Art der Motilität sind: Projektion der führenden Adhäsionsachse am Substrat; Adhäsion an Substrat; hintere Rückzug; und Des-Adhäsion.
Die Projektion der führenden Achse erfordert die Beteiligung von Proteinen, die an der Polymerisation und Depolimerisierung von Aktinfilamenten beteiligt sind. Die führende Achse befindet sich im Zellkortex namens Lamellipodio. Die Projektionsschritte der Achse sind:
- Rezeptoraktivierung durch extrazelluläres Signal.
- Bildung aktiver GTPASAs und 4,5-Bischoposphat-Phosphoinositol (PIP2).
- Wasp/Scar- und ARP2/3 -Proteinaktivierung, die an Aktinmonomere binden, um Konsequenzen in Aktinfilamenten zu bilden.
- Schnelles Wachstum von Aktinfilamenten am Ende mit Myosin, Verzweigung. Der Membranschub wird vorwärts erzeugt.
- Höhepunkt der Dehnung, die durch Deckproteine erzeugt wird.
- ATP -Hydrolyse, die in den ältesten Filamenten an Actin gebunden ist.
- Depolimerisierung des Actin-Ad der von ADF/Cofilina geförderten Filamente.
- ADP-Austausch durch ATP-katalysierte von Prophylaine und erzeugt Aktin G-ATP, der bereit ist.
Actin -bezogene Krankheiten
Muskeldystrophie
Muskeldystrophie ist eine degenerative Erkrankung des Skelettmuskels. Es wird regelmäßig vererbt und mit dem X -Chromosom verbunden. Betrifft hauptsächlich Männer mit hoher Frequenz in der Bevölkerung (einer von 3.500 Männer). Die Mütter dieser Männer sind asymptomatisch heterozygot und können keine Familiengeschichte haben.
Es gibt zwei Formen der Muskeldystrophie, Duchenne und Becker, und beide werden durch Defekte im Dystrophin -Gen verursacht. Diese Mängel bestehen aus Deletionen, die Axone beseitigen.
Dystrophin ist ein Protein (427 kDa), das Kreuzbindungen zwischen Aktinfilamenten bildet. Es hat eine Beherrschung der Vereinigung zu Actin im N-terminalen und eine Beherrschung der Membrane Union im C-terminalen. Zwischen beiden Domänen befindet sich eine dritte tubuläre Domäne, die durch 24 Tandem -Wiederholungen gebildet wird.
Im kortikalen Muskel -Retikulum beteiligt sich Dystrophin an der Vereinigung der Aktinfilamente zur Plasmamembran durch einen Glykoprotikerkomplex. Dieser Komplex bindet auch an extrazelluläre Matrixproteine.
Bei Patienten, denen es an funktionellem Dystrophin fehlt und mit Duchenne -Muskeldystrophie das kortikale Zytoskelett ist, unterstützt die Plasmamembran nicht. Folglich wird die Plasmamembran durch den Stress wiederholter Muskelkontraktionen beschädigt.
Verweise
- Devlin, t.M. 2000. Biochemie. Redaktionsreverté, Barcelona.
- Gunst, s.J., und Zhang, w. 2008. Actin -Zytoskelett -Dynamik im glatten Muskel: Ein neues Paradigma für die Regulierung der Kontraktion der glatten Muskulatur. Am J Physiolzell Physiol, 295: C576-C587.
- Lodisch, h., Berk, a., Zipurski, s.L., Matsudaria, p., Baltimore, d., Darnell, J. 2003. Zell- und Molekularbiologie. Editorial Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexiko, Sāo Paulo.
- Nelson, d. L., Cox, m. M. 2008. Lehninger-Prinzipien der Biochemie. W.H. Freeman, New York.
- Pfaendtner, j., Vom Kreuz und. M., Voth, g. 2010. Actin -Filament -Umgestaltung durch Actin -Depolymerisationsfaktor/Cofilin. PNAs, 107: 7299-7304.
- Pollard, t.D., Borisy, g.G. 2003. Zelluläre Motilität, die durch Zusammenbau und Demontage von Aktinfüllungen angetrieben wird. Zelle, 112: 453-465.
- « Apolipoproteine Was sind, Funktionen, Typen, Typen
- Primärer Alkoholstruktur, Eigenschaften, Nomenklatur, Beispiele »

