Adenilato Ciclasa -Eigenschaften, -Typen, Funktionen
- 4617
- 914
- René Riediger
Der Cyclasa Adenylat entweder Adenylciclase Es ist das Enzym, das für die ATP-Umwandlung verantwortlich ist, ein energiegeladenes Molekül, in cyclischem AMP, einem wichtigen Signalmolekül, das verschiedene cyclische AMP-Proteine mit wichtigen physiologischen Funktionen aktiviert.
Seine Aktivität wird durch verschiedene Faktoren kontrolliert, wie die konzertierte Wirkung von Hormonen, Neurotransmitter und anderen regulatorischen Molekülen unterschiedlicher Natur (zweiwertige Calciumionen und G -Proteine, um nur einige zu nennen).
 Cyclasa Adenylatdiagramm (Quelle: Benutzer Bensaccount On.Wikipedia [Public Domain] über Wikimedia Commons)
Cyclasa Adenylatdiagramm (Quelle: Benutzer Bensaccount On.Wikipedia [Public Domain] über Wikimedia Commons) Die wichtigste Bedeutung dieses Enzyms liegt in der Transzendenz des Produkts der Reaktion, die katalysiert, der cyclische Verstärker, da es an der Kontrolle vieler Zellphänomene im Zusammenhang mit dem Stoffwechsel und der Entwicklung sowie mit der Reaktion auf verschiedene externe Stimuli beteiligt ist.
In Natur.
Phylogenetische Studien belegen, dass diese Enzyme vor der Trennung von Eubakterien und Eukaryoten aus einem gemeinsamen Vorfahren stammen, was darauf hindeutet.
Es ist möglich, eine solche Aussage zu akzeptieren, da die von der Adenilat -Cyclase katalysierte Reaktion leicht reversibel ist, was in der Gleichgewichtskonstante für die Synthese von ATP (KGl ≈ 2.1 ± 0.2 10-9 M2).
[TOC]
Eigenschaften und Struktur
Die meisten eukaryotischen Cyclast -Adenylatenzyme sind mit der Plasmamembran assoziiert, aber in Bakterien und in Säugetier -Spermien werden sie als lösliche Proteine im Cytosol gefunden.
In Hefen und einigen Bakterien handelt.
Strukturelle Eigenschaften
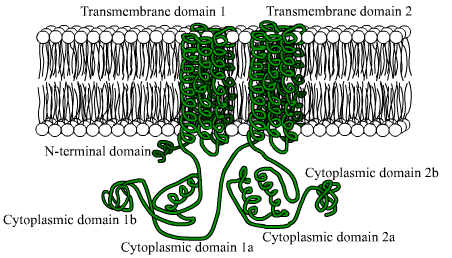
Es sind Proteine, die aus großen Polypeptidketten (von mehr als 1 bestehen.000 Aminosäureabfälle), die die Plasmamembran 12 -mal mittels zwei Regionen aus sechs Transmembran -Domänen der Konformationsalpha überqueren, die bestehen.
Jede transmembranale Region wird durch eine große zytosolische Domäne getrennt, die für die katalytische Aktivität verantwortlich ist.
Kann Ihnen dienen: Flora und Fauna aus Afrika: repräsentative ArtenUnter den eukaryotischen Organismen gibt es einige Gründe, die in einem Fragment der Amino -Terminalregion dieser Enzyme aufbewahrt werden, sowie eine zytoplasmatische Domäne von etwa 40 kDa, die durch die hydrophoben Schnitte abgegrenzt wird.
Katalytische Stelle
Die Reaktion, die diese Enzyme katalysieren, dh die Bildung einer Dieterbindung durch einen nucleophilen Angriff der OH -Gruppe in 3' -Position zur Phosphatgruppe des Nucleosid Trphosphat in Position 5 ' Domain Palm ".
Diese Domäne von "Palma" besteht aus einem Grund "βαβαβ"(" Β ", die die β-gepflegten und" α "-Flätter für Alpha-Propeller bezeichnen wollen) und hat zwei unveränderliche, anstrengbare Säurereste, die die beiden Metallionen koordinieren, die für die Katalyse verantwortlich sein können, die zweiwertige Magnesium- oder Magnesiumionenzink-Zink sein können.
Viele Studien, die sich auf die quartäre Struktur dieser Enzyme beziehen, haben gezeigt, dass ihre katalytische Einheit als Dimer existiert.
Standort
Es wurde festgestellt, dass wie viele umfassende Proteine der Membran -umfassenden Proteine wie G -Proteine, diejenigen mit Phosphatidylinositolankern und vielen anderen, Adenylcicses in Regionen oder speziellen Mikrodomänen von Membran gefunden werden "Lipidfloß").
Diese Membrandomänen können bis zu Hunderte von Nanometern im Durchmesser haben und bestehen hauptsächlich aus Cholesterin und Sphingolipiden mit überwiegend gesättigten Fettsäureketten und großer lang.
Cyclasas Adenilat haben sich auch mit Subregionen von Lipidflößen in Verbindung gebracht, die als "Caveolas" (English "bekannt sindCaveolae "), die eher Invaginationen der Membran sind, die reich an Cholesterinreich sind und ein Protein, das mit diesem assoziiert ist, das Caveolina genannt wird.
Leute
In Natur.
Kann Ihnen dienen: Oxihemoglobin: Eigenschaften, Struktur und Vereinigung Kurve- Klasse I: Sie sind in vielen grammnegativen Bakterien vorhanden, wie sie UND. coli, Zum Beispiel, wenn das zyklische AMP -Produkt der Reaktion Funktionen wie Ligand für Transkriptionsfaktoren hat, die für die Regulierung von katabolen Operaten verantwortlich sind.
- Klasse II: Sie sind in einigen Krankheitserregern von Bakteriengenres wie zu finden Bazillus entweder Bordetella, wo sie als extrazelluläre Toxine dienen. Sie sind Proteine, die von Wirt Calmodulin aktiviert werden (fehlt in Bakterien).
- Klasse III: Sie sind als "universelle" Klasse bekannt und sind phylogenetisch mit den Guanilaato -Cyclasas verwandt, die ähnliche Funktionen erfüllen. Sie werden sowohl in Prokaryoten als auch in Eukaryotas gefunden, wo sie auf verschiedenen Straßen reguliert werden.
Adenylat -Säugetiercyclasas
Bei Säugetieren wurden mindestens neun Arten dieser Enzyme kloniert und beschrieben.
Diese teilen komplexe Strukturen und Membran -Topologien sowie doppelte katalytische Domänen, die für sie charakteristisch sind.
Für Säugetiere entspricht die Nomenklatur, die verwendet wird, um sich auf Isoformen zu beziehen Cyclasa Adenylat) und zu einer Zahl von 1 bis 9 (AC1 - AC9). Es wurden auch zwei Varianten des AC8 -Enzyms berichtet.
Die in diesen Tieren vorhandenen Isoformen sind ein Gegenstück in Bezug auf die Abfolge der Primärstruktur ihrer katalytischen Stellen und der dreidimensionalen Struktur. Die Einbeziehung eines dieser Enzyme in jeden "Typ" hängt hauptsächlich mit den Regulationsmechanismen zusammen, die auf jeder Isoform arbeiten.
Sie haben Expressionsmuster, die oft gewebespezifisch sind. Im Gehirn finden Sie alle Isoformen, obwohl einige auf bestimmte Bereiche des Zentralnervensystems beschränkt sind.
Funktionen
Die Hauptfunktion der Enzyme, die zur Cylasa -Adenylatfamilie gehören die Freisetzung eines Pyrophosphatmoleküls.
Bei Säugetieren wurden die verschiedenen Varianten, die erreicht werden können.
Kann Ihnen dienen: Parasitismus: Konzept, Typen und BeispieleEinige Autoren haben angegeben, dass Cyclasas -Adenylat eine zusätzliche Funktion wie Transportmoleküle oder, die gleiche Kanalproteine und Ionic -Förderer sind.
Diese Hypothesen wurden jedoch in Abhängigkeit von der Anordnung oder Topologie der Transmembran -Segmente dieser Enzyme nur nachgewiesen, die einige strukturelle Homologien oder Ähnlichkeiten (aber nicht Sequenz) mit bestimmten Ionentransportkanälen aufweist.
Sowohl der cyclische AMP als auch das PPI (Pyrophosphat), die die Reaktionsprodukte sind, haben Funktionen auf zellulärer Ebene; Aber seine Bedeutung hängt vom Organismus ab, wo sie sind.
Verordnung
Die große strukturelle Vielfalt zwischen den Adenylciclasses zeigt eine große Anfälligkeit für mehrere Regulierungsformen, die es ihnen ermöglicht, sich in eine Vielzahl von zellulären Signalwegen zu integrieren.
Die katalytische Aktivität einiger dieser Enzyme hängt von Alpha -Ketoaziden ab, während andere viel komplexere Regulationsmechanismen aufweisen, die regulatorische Untereinheiten (durch Stimulation oder Hemmung) beinhalten Proteine.
Viele Cyclasas -Adenilat werden durch Untereinheiten einiger G -Proteine (hemmen ihre Funktion) negativ reguliert, während andere eher Aktivatoren ausüben.
Verweise
- Cooper, d. M. F. (2003). Regulierung und Organisation von Adenylyl -Zyklassen und Camp. Journal Biochemical, 375, 517-529.
- Cooper, d., Mons, n., & Karpen, J. (1995). Adenylylzyklasen und die Wechselwirkung zwischen Kalzium und Camp Sigaling. Natur, 374, 421-424.
- Danchin, a. (1993). Phylogenie von Adenylylzyklassen. Fortschritte in der zweiten Boten- und Phosphoproteinforschung, 27, 109-135.
- Hanoune, j., & Defer, n. (2001). Regulation und Rolle von Adenylylcyclase -Isoformen. Ann. Rev. Pharmakol. Toxicol., 41, 145-174.
- Grenze, u., & Schultz, J. UND. (2003). Die Adenylyl-Zyklassen der Klasse III: Mehrzweck-Signalmodule. Zelluläre Signalübertragung, fünfzehn, 1081-1089.
- Tang, w., & Gilman, zu. G. (1992). Adenylyl -Zyklasen. Zelle, 70, 669-672.
- « Beugung des Klangs, aus dem er besteht, Beispiele, Anwendungen
- Hintergrund des Weihnachtsmanns, Ziele, Konsequenzen »

