Elektronische Affinität

- 2036
- 168
- Ivan Pressler
Was ist elektronische Affinität?
Der Elektronische Affinität Es ist definiert als die Menge an Energie, die freigesetzt wird, wenn ein Mol von Atomen im gasförmigen Zustand mit einem Mol Elektronen kombiniert wird, um einen Mol von Anionen zu bilden, ebenfalls in einem gasförmigen Zustand. Mit anderen Worten, es bezieht sich auf das Negativ der Enthalpie -Variation des folgenden Prozesses:
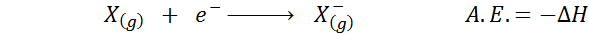
Wie der Name schon sagt, elektronische Affinität (a.UND.) Es ist ein Maß für den Trend, der ein Atom hat, um sich einem Elektron anzuschließen. Das heißt, es misst die Affinität eines Atoms für Elektronen.
Interpretation der elektronischen Affinität
Aufgrund der definierten Art und Weise impliziert eine hohe elektronische Affinität, dass die Enthalpievariation sehr negativ ist. Dies zeigt wiederum, dass der Prozess energetisch günstig ist und dass die Produkte stabiler sind als die Reagenzien. Aus diesem Grund könnten wir auch sagen, dass die elektronische Affinität ein indirektes Maß für die Stabilität eines Anion ist.
Je größer die elektronische Affinität eines Atoms ist, desto größer ist der Trend, den Anion zu bilden. Aus diesem Grund bilden Atome wie Chlor, deren elektronische Affinität 349 kJ/Mol beträgt.
Klarstellung zur elektronischen Affinität und Ionisierungsenergie
Oft denken Sie über die elektronische Affinität als das Gegenteil von Ionisationsenergie (die Tendenz eines gasförmigen Atoms, ein Elektron zu verlieren), aber das ist dies nicht der Fall. Betrachten Sie zum Beispiel ein Atom x.
Es kann Ihnen dienen: Tusfrano: Chemische Struktur, Eigenschaften und VerwendungSeine elektronische Affinität bezieht sich auf die Energieveränderung des oben gezeigten Prozesses in der ersten Gleichung. Seine Ionisierungsenergie bezieht sich jedoch auf die Energieveränderung, wenn das Atom ein Elektron verliert:
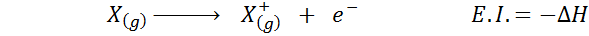
Obwohl diese Reaktion die entgegengesetzte Reaktion auf die vorherige zu sein scheint.
Was bestimmt die elektronische Affinität?
Um zu wissen, welche Eigenschaften eines Atoms den Wert seiner elektronischen Affinität beeinflussen, muss die Stabilität des ursprünglichen Atoms sowie die des gebildeten Anions berücksichtigt werden. Wenn das Anion stabiler ist als das Atom, ist die elektronische Affinität hoch, andernfalls ist es niedrig oder sogar negativ.
Aber wie man weiß, welche der beiden Arten stabiler ist? Dafür verlassen wir uns auf zwei Faktoren:
- Elektronische Konfiguration. Es gibt stabilere elektronische Einstellungen als andere. Im Allgemeinen ist die Full -Layer -Konfiguration (wie edle Gase) die stabilste von allen. Anschließend folgt die Semi-Llena-Schichtkonfiguration, in der alle Orbitale der Valencia-Schicht die Hälfte der Elektronen haben, die sie haben könnten (z. B. 4s14p3).
- Elektronische Abstoßung. Wenn ein Lastanion -1 mit einem Lastanion -2 verglichen wird, gibt es im zweiten Fall viel mehr Abstoßung zwischen den Elektronen, was Anion destabilisiert.
Periodische Elektronin -Affinitätstendenz
 Grafik zeigt die elektronischen Affinitäten der ersten 9 Elemente der Periodenzüchtertabelle
Grafik zeigt die elektronischen Affinitäten der ersten 9 Elemente der Periodenzüchtertabelle Die elektronische Affinität ist eine der regelmäßigen Eigenschaften der Elemente. Das heißt, es handelt sich um eine Eigenschaft, die je nach Position in der Periodenzüchter vorhersehbar von einem Element zum anderen variiert. Im Allgemeinen steigt die elektronische Affinität mit abnehmender Atomgröße.
Es kann Ihnen dienen: Semi -entwickelte Formel: Was ist und Beispiele (Methan, Propan, Butan ...)In diesem Sinne variiert die Größe der Atome je nach Zeitraum und Gruppe, in der sie sich befindet, und so variiert auch die elektronische Affinität wie unten erläutert:
Variation der elektronischen Affinität über einen Zeitraum
Zumindest für die repräsentativen Elemente (diejenigen, die zu den S- und P -Blöcken der Periodenkabine gehören) kann beobachtet werden, dass die elektronische Affinität aufgrund der Zunahme der effektiven Kernbelast kann Elektronen mit größerer Kraft anziehen.
Wenn wir beispielsweise die 3. Periode des Periodenzüchtertabels einnehmen (328 kJ /mol).
Ausnahmen
Die vorherige Regel ist nicht immer erfüllt.
Erstens nimmt die elektronische Affinität beim Übergang von alkalischen Metallen zu Alkalinern ab. Dies liegt daran, dass für alkalische Metalle (elektronische NS -Konfiguration NS1) Es ist günstig, ein Elektron zu erfassen, da sie das Füllen ihres Orbitals beenden würden.
Im Falle von Alkalineros (elektronische Konfiguration NS2) Es ist ungünstig, ein Elektron zu erfassen, weil sie bereits ihr volles Orbital haben. Gleiches gilt für den Umzug von Halogenen (die die elektronischen Affinitäten aller Elemente haben) zu den edlen Gasen.
Variation der elektronischen Affinität in einer Gruppe
Bei Gruppen ist das Verhalten noch weniger vorhersehbar. Die allgemeine Regel ist, dass die a.UND. Erhöht sich von unten nach oben in die gleiche Richtung, die den Atomradius verringert. Für alkalische und Halogenmetalle ist diese Regel recht gut erfüllt. Dies geschieht jedoch nicht bei den meisten anderen Gruppen.
Kann Ihnen dienen: KobalthydroxidBeispiele für die elektronische Affinität einiger repräsentativer Elemente
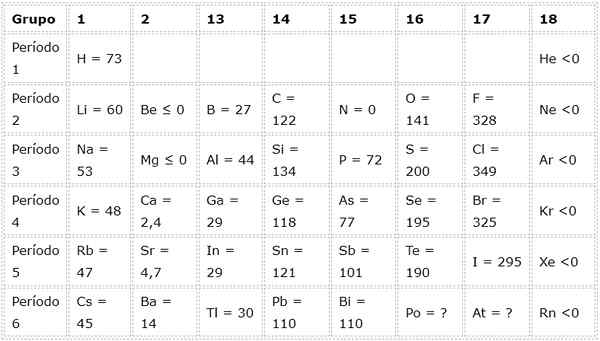
Die folgende Tabelle zeigt elektronische Affinitätswerte in (kj/mol) von Die repräsentativen Elemente Sortiert nach Gruppen:
Im Folgenden finden Sie einige Beispiele für die elektronische Affinität zusammen mit der Reaktion, auf die sie sich beziehen:
1. Wasserstoff elektronische Affinität
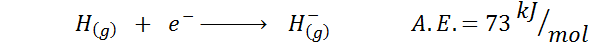
2. Elektronische Sauerstoffaffinität
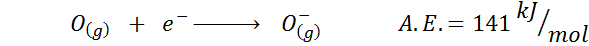
3. Anion Elektronische Affinität
Ein weiteres häufiges Beispiel ist der Fall der elektronischen Affinität eines Anion wie oder-. Die a.UND. In diesem Fall ergibt sich die Energie, die mit dem folgenden Prozess verbunden ist:
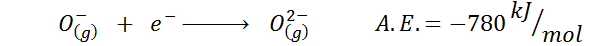
Wie zu sehen ist, ist diese elektronische Affinität stark negativ, obwohl das Ion oder2- Es hat die elektronische Neonkonfiguration (ein edles Gas) und ist bei vielen ionischen Feststoffen ein sehr häufiges Ion.
Der Grund ist, dass die Abstoßung negativer Ladungen in der OR2- Destabilisiert dieses gasförmige Zustandionen, aber im festen Zustand wird die Last durch die Kationen, die sie umgeben, stabilisiert.

