Emb
- 1630
- 418
- Ibrahim Steuk
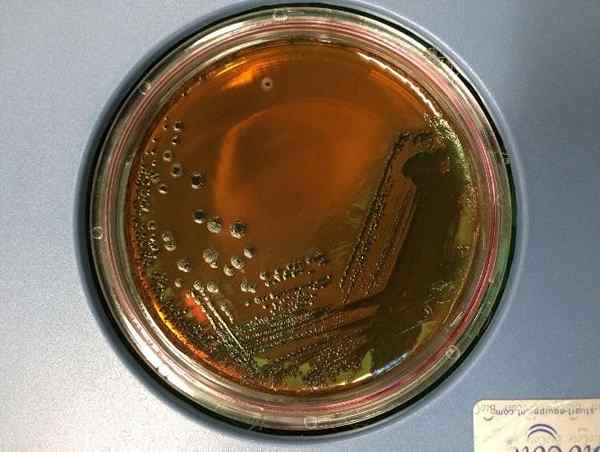
 E LUNGERANGULAR FEIN. Coli auf AMB -Agar. Quelle: Eunice Laurent, CC BY-SA 4.0, Wikimedia Commons
E LUNGERANGULAR FEIN. Coli auf AMB -Agar. Quelle: Eunice Laurent, CC BY-SA 4.0, Wikimedia Commons Was ist der Agar emb?
Er Emb Es handelt. Es ist auch mit dem Akronym EAM bekannt, was Eosina-Azul von Methylen bedeutet.
Dieses Medium wurde 1916 von Holt-Harris und Teague geschaffen. Es enthält Pepton, Lactose, Saccharose, Dipotium -Phosphat, Agar, Eosin, Methylenblau und Wasser. Es ist dem MacConkey -Agar sehr ähnlich, insbesondere wenn der BEB -Agar von Levine verwendet wird, der keine Saccharose enthält.
Tatsächlich entscheidet jedes Labor, ob es mit dem einen oder anderen funktioniert, da sie dieselbe Funktion erfüllen, obwohl sie biochemisch unterschiedlich sind.
Es zeigt sogar die gleichen Unannehmlichkeiten wie der klassische MacConkey -Agar in der Produktion von Swarming für das Geschlecht Proteus. Um dieses Phänomen zu vermeiden, kann die Konzentration des Agars daher um bis zu 5% erhöht werden.
Basis
Selektiv
Der EMP -Agar ist subtil selektiv, weil es anilinische (Eosin- und Methylenblau) -Färbung enthält, die als Inhibitoren fungieren, wodurch das Wachstum der meisten grampositiven Bakterien und einige anspruchsvolle anspruchsvolle anspruchsvolle Bazillen verhindert werden.
Dieser Agar hat jedoch die Unannehmlichkeiten, dass einige grampositive Bakterien dem Vorhandensein hemmender Substanzen widerstehen und als kleine farblose Leistung wachsen können, wie das, wie die Enterococcus faecalis und einige Staphylococcus.
Bestimmte Hefen können auch wachsen, wie z Candida albicans Komplex, Das wird sehr kleine rosa Kolonien geben. Clamidosporen können sich sogar aus dieser Hefe entwickeln, wenn die Probe durch Tiefe gesät wird.
Differential
Andererseits ist EMB -Agar auch ein Differentialmedium, da diese Farbstoffe (Eosin und Methylenblau) die Eigenschaft haben, einen Niederschlag im sauren pH zu bilden, daher dienen sie als Indikatoren für die Produktion derselben.
Kann Ihnen dienen: AllometrieDaher produzieren schwach fermentierende oder Saccharose -Bakterien in 24 bis 48 Stunden lila Farben. Zum Beispiel Genres Klebsiella, Enterobacter Und Serratia.
Diese Bakterien, die Laktose stark fermentieren, wie z Escherichia coli, oder Saccharose wie Enterokolithische Yersinia entweder Proteus Penneri, Sie bilden einen grünlich -schwarzen Niederschlag, der in diesen Spezies charakteristisch ist.
Es ist zu beachten, dass, wenn das Emb -Levine -Medium verwendet wird (ohne Saccharose), Enterokolithische Yersinia Und Proteus Penneri Sie werden transparente Kolonien produzieren.
Bakterien, die Laktose oder Saccharose nicht fermentieren. Zum Beispiel Genres Salmonellen Und Shigella, unter anderen.
Es ist auch wichtig, dieses Geschlecht zu betonen Acinetobacter Es kann blaue Lavendelkolonien aufweisen, auch wenn es sich nicht um Lactose -Fermeter oder Saccharose handelt, sondern sie haben die Eigenschaft, das Methylenblau an der Zellwand zu fixieren. Dies kann auch bei anderen oxidativen Bakterien passieren.
Vorbereitung
Das ursprüngliche dehydrierte Medium ist leicht beige. Um dieses Kulturmedium vorzubereiten, müssen 36 Gramm des dehydrierten Medium.
Nachdem Sie die Mischung 5 Minuten in Ruhe gelassen haben, nehmen Sie das Fixola zu einer Wärmequelle und mischen Sie in kräftiger und konstanter Weise, bis sie sich vollständig kocht und sich vollständig auflöst.
Anschließend muss das bereits gelöste Kulturmedium mit dem Autoklav bei 121 ° C 15 Minuten sterilisiert werden.
Die Zeit ist abgeschlossen, es wird aus dem Autoklav entfernt und kurz stehen lassen. Dann ist es immer noch heiß (45-50 ° C) zwischen 15 und 20 ml Agar auf jeder Petrisch-Sterilplatte. Das Medium muss blauer Lackmus sein.
Kann Ihnen dienen: Amilase: Eigenschaften, Klassifizierung, Struktur, FunktionenNach dem Servieren bleiben die Teller leicht unbedeckt, bis der Agar etwas abkühlt. Dann sind sie bedeckt und erlaubt sich vollständig festigen. Anschließend werden sie in umgekehrten Plättchen bestellt und in Kühlschrank (8 ° C) bis zur Verwendung gelagert.
Dieses Verfahren wird vorzugsweise in einer laminaren Strömungsglocke oder vor Bunsen -Feuerzeug durchgeführt, um eine Verunreinigung zu verhindern.
Es ist wichtig zu bedenken, dass jedes Handelshaus die Menge angibt, die gewogen werden muss, um das Kulturmedium vorzubereiten.
Der letzte pH des Mediums muss 7 sein.2 ± 0.2
Anwendungen
- Dieses Medium wird verwendet.
- Die enteropathogenen Bakterien der Genres Shigella Und Salmonellen Sie unterscheiden sich durch ihre farblosen oder leicht bernsteinfarbenen Kolonien.
- Andere nicht -fermentierende Bazillen wachsen, wie z Aeromonas, Pseudomonas, Acinetobacter, unter anderen.
- Außerdem ist dieses Medium sehr nützlich bei der mikrobiologischen Analyse von Nahrung und Wasser, da es ideal für die vollständige Bestätigungsphase der Bestimmung von Coliformen ist, dh das Vorhandensein von zu bestätigen UND. coli Aus trüben EC -Brühen aus der wahrscheinlichsten Zahlen -Technik (NMP).
QA
Um zu überprüfen, ob das neu vorbereitete Kulturmedium gut funktioniert, können Kontrollen gesät werden, um die Eigenschaften der Kolonien zu beobachten und zu überprüfen, ob sie wie erwartet geben.
Dazu können Sie ATCC -Stämme oder gut identifizierte Stämme von verwenden UND. coli, Enterobacter aerogenes, Klebsiella sp, Salmonella typhimurium, Shigella Flexneri, Pseudomonas aeruginosa und einige grampositive Bakterien wie z S. aureus.
Es wird erwartet, dass das UND. coli Erzeugen Sie gut entwickelte bläuliche schwarze Kolonien mit grünem metallischem Glanz. Während Enterobacter aerogenes Und Klebsiella sp Sie müssen gut entwickelte Schleimkolonien bläulich schwarz geben.
Es kann Ihnen dienen: WinOgrasky -SpalteFür seinen Teil, Salmonellen Typhimurium Und Shigella Flexneri Sie müssen große, farblose Kolonien oder mit einer leichten Bernsteinfarbe entwickeln.
Schließlich das Genre Pseudomonas aeruginosa Es wächst als farblose Kolonien unregelmäßiger Größe, während grampositive Bakterien vollständig gehemmt oder mit sehr kleinen Kolonien aufwachsen sollten.
Schlussbetrachtungen
Manchmal führt die Sterilisation dazu, dass Methylenblau ein orangefarbenes Medium beobachtet und beobachtet. Damit Methylenblau Oxid zu oxidieren und die lila Farbe wiedererlangt, muss es vorsichtig gemischt werden, bis sich die Farbe erholt.
Nach der Sterilisierung kann der Farbstoff ausfällt, so dass er vor dem Servieren der Petri -Platten gut gemischt werden muss.
Verweise
- Eosina und Methylenblau -Agar. Von Kalib geborgen.com.
- Levine e.M.B. (Mit Eosina und Methylenblau). Von Britanialab geborgen.com.

