Wismutsulfite -Agentur, Vorbereitung und Verwendung
- 5080
- 573
- Nick Laurén
Er Wismutsulfitagar Es handelt Salmonella enterica subgrupo enterica typhi seretypo, Unter anderen Salmonellenarten. Die Umwelt ist als BSA bekannt im englischen Wismutsulfit -Agar einverstanden.
Die ursprüngliche Wismutsulfit -Agar -Formel wurde 1927 von Wilson und Blair (Glucose Bismutsulfiteisenmedium) erzeugt; Diese enthielt Natriumsulfit, Glukose, Wismutlösung, Ammoniumcitrat, Eisensulfat und Agar-Anschluss.
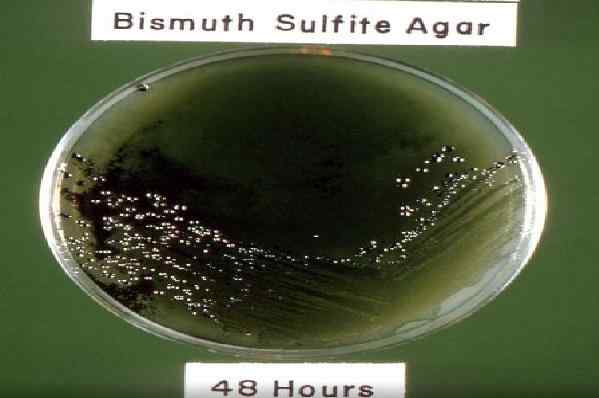
 48 -stündiges Wachstum der Salmonellen -SP -Inkubation in Wismutsulfitagar. Quelle: Pixnio.com Autor: Dr. W. R. Erving, USCDCP
48 -stündiges Wachstum der Salmonellen -SP -Inkubation in Wismutsulfitagar. Quelle: Pixnio.com Autor: Dr. W. R. Erving, USCDCP Heutzutage gibt es eine Modifikation des ursprünglichen Medium.
Es gibt viele Mittel zur Isolierung von Salmonellenspezies, aber wenn es darum geht, den Typhi -Serotyp wiederherzustellen.
Es ist jedoch notwendig, mehr als eine Art von Medium zu verwenden, wenn es um die Isolierung von Enteropathogenen geht, da der Wismutsulfit -Agar für andere Salmonellenspezies und für die Shigella -Gattung, die in diesem Agar inhibiert oder sich sehr schlecht entwickeln, weniger wirksam ist.
Es ist zu beachten. Diese Serovarität erzeugt Typhus, Gastroenteritis, Bakteriämie und Septikämie.
Aus diesem Grund ist es relevant, diesen Agar bei der Analyse von Wasser, Kot oder Lebensmitteln zu berücksichtigen, wenn Ihre Anwesenheit vermutet wird.
[TOC]
Basis
Als die meisten Kultivierungsmedien enthält Wismutsulfit -Agar -Substanzen zur Förderung der Bakterienentwicklung wie Peptones und Fleischextrakt. Ebenso fungiert Glukose als Energie- und Kohlenstoffquelle.
Kann Ihnen dienen: Biogenetische ElementeJetzt wachsen nicht alle Bakterien in diesem Medium, da Wismutsulfitagar ein selektives Medium ist. Diese enthält Verbindungen, die das Wachstum von gram positiven Mikroorganismen und bestimmte Gram -negative Bakterien hemmen. Diese Verbindungen sind: der Wismutsulfitindikator und hellgrün.
Andererseits behält das Dinatriumphosphat die Osmolarität und den pH -Wert des Mediums bei.
Darüber hinaus ist Wismutsulfitagar ein Differentialmedium dank des Vorhandenseins von Eisensulfat, das die Bildung von H zeigt2S. Die h2S gebildet durch Bakterien reagiert mit Eisensulfat und bildet einen deutlich sichtbaren unlöslichen Niederschlag.
Schließlich bietet Agar -Agar die Umwelt solide Konsistenz.
Vorbereitung
52,3 g des dehydrierten Mediums wiegen und in einem Liter Wasser auflösen. Erhitzen Sie die Mischung 1 Minute mit häufiger Aufregung bis zu seiner Gesamtauflösung. Nicht zu sehr überhitzen. Dieses Medium ist in Autoklaven nicht sterilisiert, da die extreme Wärme das Kulturmedium schädigt.
Lassen Sie bei 45 ° C abkühlen und schütteln Sie, bevor Sie auf Petrisch -Sterilplatten servieren. Es wird empfohlen, Platten mit guter Dicke zu machen. Dafür müssen 25 ml in jede Tafel gegossen werden. Verfestigen lassen. Wie ein Mittel, das nicht sterilisiert wird, ist es normal, dass es sofortig verwendet wird, vorgeschlagen zu werden.
Eine Studie von D'AUST im Jahr 1977 zeigte jedoch, dass es eine bessere Genesung von gibt Salmonella typhimurium Und Salmonella Enteritidis Mit dem Wismutsulfitmedium ist die Leistung für Serovare nicht beeinflusst Typhi Und Parathyphi b.
D'Aous empfiehlt die Verwendung der Platten bis zum vierten Tag der Kühlung, obwohl es warnen Proteus vulgaris.
Aus diesem Grund ist es für sehr verschmutzte Proben wie Kot vorzuziehen, das neu vorbereitete Medium zu verwenden. Ansonsten bis Tag 4 der Vorbereitung verwendet. Andere Autoren empfehlen, die Platten am Tag nach ihrer Vorbereitung zu verwenden, die in Kühlung gespeichert ist.
Kann Ihnen dienen: Uracil: Struktur, Funktionen, Eigenschaften, SyntheseKühlplatten sollten vor der Verwendung temperamentvoll sein. Der mittlere pH -Wert muss 7,5 ± 0,2 betragen. Die Farbe des unbezahlten Mediums ist beige und vorbereitet opalescente grünlich grau.
Anwendungen
Unter den Proben, die in diesem Medium gesät werden können.
Um die Isolate zu verbessern, wird empfohlen, eine Behandlung vor der Anreiz mit Laktosebrühe und nach der Anreicherung mit Tetrapationat-Brühe oder Selenito-Brühe Cystin durchzuführen, bevor Sie in Wismutsulfitagar säen.
Die Platten werden 24 bis 48 Stunden bei 35 ° C ± 0,2 in der Aerobiose inkubiert.
Eigenschaften der Kolonien in Wismutsulfitagar
Die Kolonien von Salmonella typhi Sie werden normalerweise in diesem Agar in 24 Stunden mit einem schwarzen Zentrum gesehen und von einem hellgrünen Heiligenschein umgeben. Während sich in 48 Stunden schwarz aufgrund der Bildung von Schwefelwasserstoff vollständig umdreht.
Salmonella parathyphi a präsentiert Kolonien mit variablen Eigenschaften. Nach 18 Stunden Inkubation können schwarze, grüne oder transparente Kolonien beobachtet werden, mit Schleimhaut auftreten. Während sie nach 48 Stunden völlig schwarz und manchmal mit einer ausgeprägten metallischen Helligkeit beobachtet werden.
S. Parathyphi a Es neigt dazu, das Medium um die Kolonie umzugehen.
Salmonella sp Schwarz oder Greyercolonias -Grundstücke mit oder ohne metallisch hell, Maying werden zur Oberfläche oder nicht.
Coliforme Stämme sind normalerweise völlig gehemmt, aber wenn sie wachsen, entwickeln sie sich als undurchsichtige grüne oder braune Kolonien und metallische Helligkeit. Färben Sie das Medium nicht um die Kolonie.
Einschränkung
-Sehr schwache Inokulums können Kolonien von verursachen Salmonella typhi Hellgrün, unbemerkt werden und die Kultur als negativ melden.
Kann Ihnen dienen: Zweige der Physiologie- Wismutsulfitagar kann die Wiederherstellung einiger Salmonellenspezies wie z S. Sendai, s. Berta, s. Gallinarum, s. Abortus-Equi.
-Dieses Medium hemmt die meisten Arten der Shigella Gattung.
- S. Typhi und s. Arizonae Sie können sehr ähnliche Kolonien geben.
-Die von h produzierten Coliformen2S wie Proteus und Citrobrobacter produzieren Kolonien, die denen von Salmonellen ähneln. Daher ist es notwendig, biochemische Identifizierungstests durchzuführen.
-Ein gutes Estria muss getan werden, um isolierte Kolonien zu erhalten; Dies ist der einzige Weg, um die typischen Eigenschaften der Kolonien der Gattung Salmonella zu beobachten.
QA
Für die Sterilitätskontrolle wird eine Plaque inkubiert, ohne bei 37 ° C zu impft. Es wird erwartet, dass es kein Wachstum oder keine Farbänderung gibt.
Für die Qualitätskontrolle können Sie bekannte Stämme säen, wie z. B.:
Escherichia coli ATCC 25922, Salmonella Enteritidis ATCC 13076, Salmonella typhi ATCC 19430, Shigella Flexneri ATCC 12022, Enterococcus faecalis ATCC 29212.
Es wird erwartet, dass das Escherichia coli Und Shigella Flexneri werden teilweise gehemmt, um grünlich -braune braune Kolonien zu entwickeln. Während beide Salmonglars eine hervorragende Entwicklung mit schwarzen Kolonien mit metallischer Helligkeit und schließlich haben müssen Enterococcus faecalis muss völlig gehemmt werden.
Verweise
- Wilson, w., & E. M. MCV. Blair. Verwendung eines Glucoseflismutsulfit -Eisenmediums zur Isolierung von B. Typhosus Und B. Proteus. Das Journal of Hygiene, 1927; 26(4), 374-391. Abgerufen von .JStor.Org
- D'AUST JY. Auswirkung von Speicherbedingungen auf die Leistung von Wismutsulfitagar. J Clin Microbiol. 1977; 5 (2): 122-124. Verfügbar in: NCBI.NLM.NIH.Regierung
- IVD Laboratories. Wismut-Sulfit-Agar nach Wilson-Blair. 2009. Verfügbar unter: Bismuthsulfitagar_span_jan_2009%20 (2).PDF
- Himedia Laboratories. Wismutsulfitagar. 2017. Erhältlich bei: Himedias.com
- Forbes B, Sahm D, Weissfeld A. (2009). Mikrobiologische Diagnose von Bailey & Scott. 12 ed. Pan -American Editorial s.ZU. Argentinien.
- Morales R, aus La Cruz D, Leyva G und Ybarra M. Bakteriologische Qualität von Rohziegenmilch in Miravalles, Puebla,. Rev Mex von Chem 2012; 11 (1): 45-54
- « Maismehl. Fundament, Vorbereitung und Verwendung
- William James Sidis der intelligenteste Mann in der Geschichte? »

