Konzeptreduzierungsmittel, die stärksten Beispiele

- 968
- 194
- René Riediger
A Reduktionsmittel Es ist eine Substanz, die die Funktion der Reduzierung eines Oxidationsmittels bei einer Oxid-Reduktionsreaktion erfüllt. Reduktionsmittel sind von Natur aus Elektronendonoren, typischerweise Substanzen, die am niedrigsten Oxidationsniveau und mit einer hohen Menge an Elektronen liegen.
Es gibt eine chemische Reaktion, bei der die Oxidationszustände der Atome variieren. Diese Reaktionen beinhalten einen komplementären Reduktions- und Oxidationsprozess. Bei diesen Reaktionen werden ein oder mehrere Elektronen eines Moleküls, Atoms oder Ion auf ein anderes Molekül, Atom oder Ion übertragen. Dies impliziert die Produktion einer Oxid-Reduktionsreaktion.

Während des Oxid-Reduktionsprozesses wird dieses Element oder die Verbindung, die (oder Dona) sein Elektron (oder Elektronen) verliert. Es wird dann gesagt, dass Reduktionsmittel das Oxidationsmittel reduzieren und dass das Oxidationsmittel das Reduktionsmittel oxidiert.
Die besten oder stärksten reduzierenden Wirkstoffe sind diejenigen, die das größte Atomradio haben. Das heißt, sie haben einen größeren Abstand von ihrem Kern zu den Elektronen, die gleich umgeben.
Reduktionsmittel sind normalerweise Metall oder negative Ionen. Unter den gemeinsamen Reduktionsmitteln befinden sich Ascorbinsäure, Schwefel, Wasserstoff, Eisen, Lithium, Magnesium, Mangan, Kalium, Natrium, Vitamin C, Zink und sogar Karottenextrakt.
[TOC]
Was sind reduzierende Mittel?
Wie bereits erwähnt, sind Reduktionsmittel für die Verringerung eines Oxidationsmittels verantwortlich, wenn eine Oxid-Reduktions-Reaktion auftritt.
Eine einfache und typische Reaktion der Oxid-Reduktionsreaktion ist die der aeroben Zellatmung:
Kann Ihnen dienen: Aluminiumhydrid (Alh3): Struktur, Eigenschaften, verwendetC6H12ENTWEDER6(s) + 6o2(g) → 6co2(g) + 6h2Oder (l)
In diesem Fall, wo Glukose (C6H12ENTWEDER6) reagiert mit Sauerstoff (oder2), Glukose verhält sich als Reduktionsmittel, um Sauerstoff Elektronen zu verleihen - das heißt, es wird oxidiert - und Sauerstoff wird zu einem Oxidationsmittel.
In der organischen Chemie gelten die am besten reduzierenden Mittel als Reagenzien, die Wasserstoff liefern (H)2) auf die Reaktion. In diesem Bereich der Chemie bezieht sich die Reduktionsreaktion auf die Zugabe von Wasserstoff zu einem Molekül.
Faktoren, die die Kraft eines Reduktionsmittels bestimmen
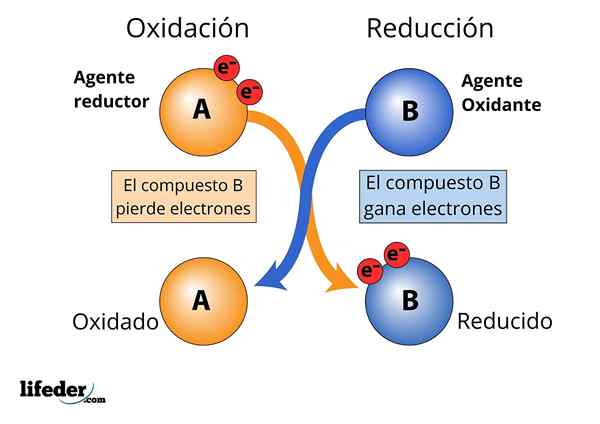 Oxidierender und reduzierender Mittel, Elektronenverlust und Gewinn werden beobachtet
Oxidierender und reduzierender Mittel, Elektronenverlust und Gewinn werden beobachtet Damit eine Substanz als "stark" betrachtet werden kann,.
Dafür gibt es eine Reihe von Faktoren, die berücksichtigt werden müssen, um die Kraft zu erkennen, die ein Reduktionsmittel haben kann: Elektronegativität, Atomradius, Ionisationsenergie und Reduktionspotential.
Elektronegativität
Elektronegativität ist die Eigenschaft, die die Tendenz eines Atoms beschreibt, ein paar Elektronen anzuziehen, die zu sich selbst vereint sind. Je höher die Elektronegativität, desto größer ist die Anziehungskraft, die das Atom um die umgebenden Elektronen ausübt.
In der Periodenzüchter steigt die Elektronegativität von links nach rechts, sodass alkalische Metalle die geringsten elektronegativen Elemente sind.
Atomradio
Es ist die Eigenschaft, die die Anzahl der Atome misst. Es bezieht sich auf den typischen oder durchschnittlichen Abstand des Zentrums eines Atomkerns zum Rand der elektronischen Wolke, die ihn umgibt.
Kann Ihnen dienen: Nitriten: Eigenschaften, Struktur, Nomenklatur, FormationDiese Eigenschaft ist nicht präzise - und außerdem sind mehrere elektromagnetische Kräfte an ihrer Definition beteiligt -, aber es ist bekannt, dass dieser Wert in der Periodenzüchtungstabelle von links nach rechts abnimmt und von oben nach unten zunimmt. Aus diesem Grund werden alkalische Metalle, insbesondere Cäsium, als größeres Atomradio angesehen.
Ionisationsenergie
Diese Eigenschaft ist definiert als die Energie, die erforderlich ist, um das weniger United -Elektron aus einem Atom (Valencia -Elektron) zu entfernen, um ein Kation zu bilden.
Je näher die Elektronen am Kern des umgebenden Atoms sind, desto größer ist die Ionisationsenergie des Atoms.
Die Ionisationsenergie steigt von links nach rechts und von unten nach oben im Periodenzüchtertisch. Wieder haben Metalle (insbesondere alkalisch) weniger Ionisationsenergie.
Reduktionspotential
Es ist das Maß für die Tendenz einer chemischen Spezies, Elektronen zu erhalten und daher reduziert zu werden. Jede Spezies hat ein intrinsisches Reduktionspotential: Je größer das Potential ist, desto größer ist die Affinität zu Elektronen und auch seine Fähigkeit, reduziert zu werden.
Reduzierende Wirkstoffe sind aufgrund ihrer geringen Affinität zu Elektronen diese Substanzen mit weniger Reduktionspotential.
Stärkere reduzierende Wirkstoffe
Mit den oben beschriebenen Faktoren kann der Schluss gezogen werden.
Wie bereits erwähnt, stellen alkalische Metalle diese Eigenschaften auf und gelten als die stärksten Reduktionsmittel.
Kann Ihnen dienen: Aliphatische Kohlenwasserstoffe: Eigenschaften, Nomenklatur, Reaktionen, TypenAndererseits gilt Lithium (LI) als das stärkste Reduktionsmittel, das das niedrigste Reduktionspotential aufweist, während das LIALH -Molekül4 Es wird als der stärkste Reduktionsmittel von allen angesehen, um diese und die anderen gewünschten Eigenschaften einzudämmen.
Beispiele für Reaktionen mit Reduktionsmitteln
Es gibt viele Fälle von Oxid-Reduktion im Alltag. Im Folgenden finden Sie einige der repräsentativsten:
Beispiel 1
Die Verbrennungsreaktion des Oktans (die Hauptkomponente von Benzin):
2 c8H18(l) + 25o2 → 16co2(g) + 18h2O (g)
Sie sehen.
Beispiel 2
Die Glukosehydrolyse ist ein weiteres nützliches Beispiel für eine häufige Reduktion:
C6H12ENTWEDER6 + 2ADP + 2p + 2nad+ → 2Ch3KOKOSNUSS2H + 2ATP + 2nadh
In dieser Reaktion nehmen die NAD -Moleküle (ein Elektronenrezeptor und Oxidationsmittel in dieser Reaktion) Glukoseelektronen (Reduktionsmittel) ein.
Beispiel 3
Schließlich bei der Reaktion von Eisenoxid
Glaube2ENTWEDER3(s) + 2al (s) → zu2ENTWEDER3(s) + 2Fe (l)
Das Reduktionsmittel ist Aluminium, während das Oxidationsmittel Eisen ist.
Verweise
- Wikipedia. (S.F.). Wikipedia. Erhalten von in.Wikipedia.Org
- BBC. (S.F.). BBC.CO.Vereinigtes Königreich. Von BBC erhalten.CO.Vereinigtes Königreich
- Pearson, d. (S.F.). Chemistry Librettexts. Erhalten von chem.Librettexts.Org
- Forschung, b. (S.F.). Bodner Research Web. Erhalten von Mured.Chem.Purdue.Edu
- Peter Atkins, L. J. (2012). Chemische Prinzipien: Die Suche nach Einsicht.
- « Cassia Angustifolia Eigenschaften, Vorbereitung, Kontraindikationen
- Azimutale Projektionsmerkmale, Typen, Vorteile, Nachteile »

