Ethylalkoholstruktur, Eigenschaften, Verwendungen, Erhalten
- 2301
- 673
- Medine Kedzierski
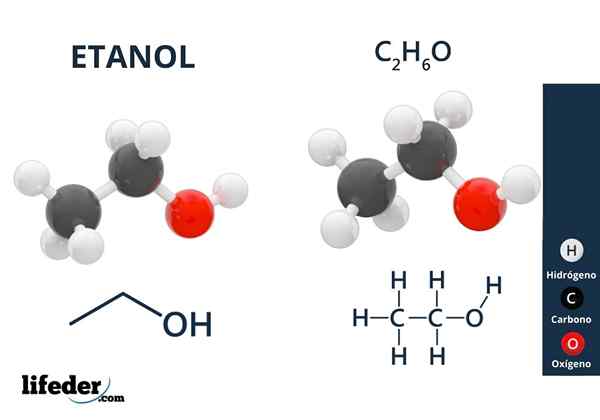
Er Ethylalkohol oder Ethanol Es ist eine organische Verbindung, deren Formel c ist2H5Oh oder ch3CH2Oh, präsentieren sich als farblose Flüssigkeit. Dies ist der zweit einfachste primäre Alkohol aller nach Methanol. Es ist sehr löslich in Wasser und in vielen organischen Lösungsmitteln, was die Entwicklung vieler ihrer Anwendungen ermöglicht hat.
Dieser Alkohol wurde zusätzlich zu seiner Verwendung bei der Synthese von Arzneimitteln und anderen organischen Chemikalien als antiseptisch und desinfektionsmittel verwendet. Es wurde auch als Kraftstoff in Heizung, Lampen und in Kombination mit Benzin in Kraftfahrzeugen verwendet.

Die Fermentation von Zucker für die Ethanolproduktion ist eine der ersten chemischen Reaktionen, die der primitive Mann gelernt hat. Eine 9000 -jährige Keramik wurde in China gefunden.
Die Zuckerfermentation führte jedoch nur zu einer sehr geringen Konzentrations -Ethanollösung, weshalb es notwendig war, Destillationstechniken zu lernen, um Wasser zu beseitigen und Alkohol zu konzentrieren. So haben griechische Alchemisten, die im 1. Jahrhundert in Alexandria arbeiteten.C., Sie wussten und benutzten die Destillation bereits.
Es gibt jedoch synthetische Routen, die es ermöglichen, ein völlig reines Ethanol basierend auf Ethylen zu erhalten, das aus Öl destilliert wird. Daher ist Öl eine indirekte Ethanolquelle. Auf diese Weise wird Ethanol oder absoluter Alkohol erhalten.
[TOC]
Ethylalkoholstruktur
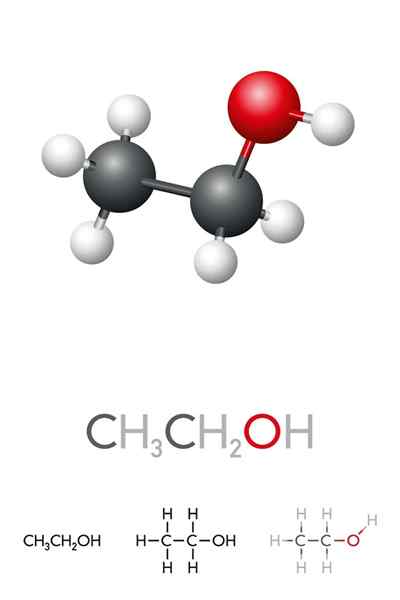
Im überlegenen Bild haben wir die molekulare Struktur von Ethanol, Cho3-CH2-Oh, dargestellt durch ein volles Weltraummodell. Es ist ein ziemlich polares Molekular, da die OH -Gruppe die elektronische Dichte des Kohlenstoffskeletts anzieht, mit dem sie verbunden ist.
Infolgedessen interagieren Ethylalkoholmoleküle durch Dipol-Dipol3CH2Oh-ohch2CH3. Deshalb hat dieser Alkohol im Vergleich zu anderen organischen Lösungsmitteln oder Flüssigkeiten einen hohen Siedepunkt.
Eigenschaften
Aussehen
Farblose Flüssigkeit.
Molmasse
46.069 g/mol
Geruch
Weicher Geruch und ähnlich wie Wein.
Geschmack
Brennen.
Dichte
0.789 g/cm3 bei 20 ºC
Schmelzpunkt
- 114.14 ºC
Siedepunkt
78,24 ºC
Wasserlöslichkeit
1 · 106 mg/l. Das heißt, es ist in allen Proportionen praktisch mischbar.
Mischbarkeit mit organischen Lösungsmitteln
Ethanol ist mit Essigsäure, Aceton, Benzol, Kohlenstofftetrachlor, Chloroform, Dietyl -Ether, Ethylenglykol, Glycerin, Pyridin und Toluol mischbar. Es ist auch mit leichten aliphatischen Kohlenwasserstoffen wie Pentano und Hexano mischbar.
Oktanol/Wasserpartitionskoeffizient
Log p = - 0.31
Dampfdruck
59.3 mm Hg bei 25 ºC. Daher hat eine wahrnehmbare Menge Dämpfe abgewiesen.
Kann Ihnen dienen: Bariumchlorid (BACL2)Wasserdampfdichte
1.59 in der Luftbeziehung als Einheit (1)
Zündungspunkt
13 ºC
Selbstdirektionstemperatur
363 ºC
Verbrennungswärme
1336.8 kJ/mol A 25 ºC
Verbrennung
Ethanol ist eine flüchtige Flüssigkeit, die mit einer blauen Flamme ohne Rauch brennt, und die für natürliches Licht praktisch unsichtbar ist.
Spezifische Wärme
0.618 Kalk/g bei 23 ° C
Schmiere
1.2 MPa · s bei 20 ° C
Brechungsindex ηd
1.3611
Verwendung von Ethylalkohol
 Eine der häufigsten Anwendungen von Alkohol ist wie antiseptisch
Eine der häufigsten Anwendungen von Alkohol ist wie antiseptisch Medizinische Anwendungen
Antiseptikum
Ethanol wird als Antiseptikum verwendet, da es eine tödliche Wirkung gegen Bakterien und Pilze hat. Es ist in der Lage, die Struktur seiner Plasmamembranen zu verändern, die seine Zerstörung durch die etablierten osmotischen Wasserflüsse erzeugen.
Ebenso kann Ethanol viele Arten von Viren zerstören. Gegenwärtig wird die Verwendung von Gelen, die Alkohol enthalten, um ihre Hände zu desinfizieren und die Ansteckung mit dem Coronavirus zu reduzieren, empfohlen. Ethanol wird auch zur Desinfektion oberflächlicher kleiner Wunden verwendet.
Drogenlösungsmittel
Viele Medikamente sind in Wasser wenig löslich und verwenden Ethanol, um ihre Löslichkeit zu erhöhen. Einige Zitzen für Husten- und Mundspülungen haben einen Ethanol -Zeitpunkt von bis zu 25%.
Schmerzbehandlung
Ethanol wird zur therapeutischen Lyse von Nerven oder Ganglien zur Linderung chronischer unlösbarer Schmerzen verwendet.
Symptomatische Schilddrüsenzystenbehandlung
Perkutane Ethanolinjektionen werden bei der Behandlung von Schilddrüsenzysten verwendet, ein einfaches Verfahren, das Komplikationen einer chirurgischen Eingriffe vermeiden könnte.
Beruhigungswirkung
Gelegentlich wird Ethanol intravenös für präoperative und postoperative Sedierung bei Patienten verabreicht, bei denen andere Maßnahmen nicht verwendbar sind.
Gegenmittel
Ethanol wird systemisch zur Behandlung der Vergiftung mit Methanol oder Ethylenglykol verwendet.
Glaukom
Ethanol wird verwendet, um den in den in den Glaukompatienten druckvollen Druck zu verringern.
Kraftstoff
Die Vereinigten Staaten konsumieren zusammen mit Brasilien 90% Ethanol, die in Autos als Treibstoff verwendet werden. Die Vereinigten Staaten sind der größte Maisproduzent der Welt und verwendet Mais als Ethanolquelle als Kraftstoff.
Die staatlich subventionierte Maiszüchter, die zwischen 1979 und 1986 die Produktion von Kraftstoffethanol von 20 Millionen Gallonen pro Jahr auf 750 Millionen Gallonen erhöhten.
Zuckerrohr ist die Hauptquelle für Ethanol in Brasilien zur Verwendung als Kraftstoff. 1943 aufgrund des Zweiten Weltkriegs.
Kann Ihnen dienen: DeuteriumSeit 1976 werden sie als Kraftstoff in Autos gemischt von Ethanol und Benzin verwendet, deren Ethanolgehalt je nach Zuckerrohrproduktion zwischen 10 und 25 %liegt.
Freizeitgebrauch
Ethanol ist in zahlreichen Getränken vorhanden, die bei sozialen Treffen und sogar beim Mittagessen und während des Familienessens eingesetzt werden.
Die anfängliche Wirkung von Alkohol, um das soziale Verhalten der Person abzubauen, erzeugt ein angenehmes und erleichtertes Umfeld der Interaktion zwischen Menschen. Überschüssiger Ethanol können jedoch toxische und unerwünschte Auswirkungen auf die persönliche Gesundheit und in Harmonie zwischen Besprechungen oder Ereignissen detonieren.
Körperpflege
Ethanol ist in vielen Kosmetika und Schönheitsprodukten vorhanden. Darüber hinaus wird es aufgrund seiner adstringierenden Wirkung in der Hautreinigung verwendet, wobei Fett und schmutzige Überreste davon eliminieren, dass Wasser und Seife es nicht tun. Es ist auch Teil der Vorbereitung vieler Lotionen und Parfums.
Essen
Die Essenz von Vanille, ein Gebrauchsgeschmack bei Kuchen und Kuchen, wird in einer Mischung aus Ethanol und Wasser gelöst. Süßigkeiten, die mit bestimmten alkoholischen Getränken gefüllt sind, werden verkauft. Alkohol wird auch als Geschmack einiger Süßigkeiten verwendet.
Ethylalkohol erhalten
Ethanol wird hauptsächlich durch Zuckerfermentation und Ethylenhydratation erhalten und proben, um es aus Kohlendioxid, Lipiden und Cellulose zu produzieren.
Fermentation
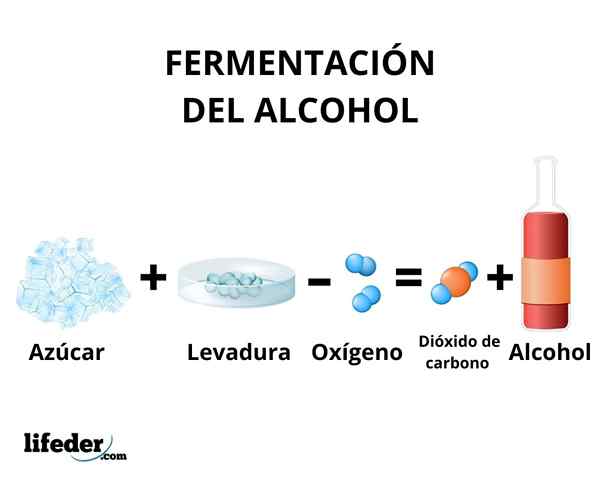
Im Fermentationsprozess erfolgt die Transformation von Kohlenhydraten in Ethanol durch die Wirkung von in der Hefe vorhandenen Enzymen. Hauptsächlich Zuckerrohr, Rüben und Getreide wie Mais und Gerste werden als Rohstoff verwendet.
Die Enzyme der Glykolyse einiger Hefespezies wie z Saccharomyces cerevisiae, Sie sind in der Lage, auf Glukose- und Saccharose -Zucker zu reagieren, um Ethanol zu produzieren. Die Konzentration des produzierten Ethanols ist durch die Anfälligkeit von Hefen gegenüber Ethanol begrenzt.
In jedem Fall liegt die durch Fermentation erzeugte Ethanolkonzentration nicht über 18%. Es ist notwendig, die Ethanollösung mit einfacher Destillation zu konzentrieren. Durch diese Methode wird eine Ethanollösung mit einer Konzentration von rund 95% erhalten.
Schließlich werden fraktionierte Destillation und 95% Alkoholdehydration für die absolute Alkoholproduktion verwendet. Ethanol, das durch Fermentation erzeugt wird, wird in der Medizin verwendet und ist als Kraftstoff reserviert, der Benzin ergänzt.
Ethylenhydratation
In diesem Prozess wird Ethylen mit hohen Temperaturen mit entionisiertem Dampf bei hohen Temperaturen zwischen 250 und 300 ° C und unter einem Druck von 6 gemischt.8 MPa. Die Umwandlung von Ethylen in Ethanol wird durch Phosphorsäure katalysiert, die auf ein Kiesel- oder Kieselalchen -Landbett gelegt werden.
Kann Ihnen dienen: mechanische Eigenschaften von MetallenDie Ethylenhydratationsreaktion kann wie folgt schematisiert werden:
C2H4 + H2O → Ch3CH2Oh
Ein Teil der Phosphorsäure wird durch Wasserdampf gezogen und sollte mit verdünntem Natriumhydroxid neutralisiert werden. Die durch Ethylenhydratation erhaltene Ethanolkonzentration ist mit einem Wert zwischen 10 und 25% niedrig.
Dann wird die Ethanollösung durch Destillation konzentriert, die eine 95% ige Ethanollösung erhält, die durch fraktionale Destillation und Dehydration 100% durchgeführt werden kann.
Andere Methoden
Aus alternativen Methoden zur Ethanolproduktion werden Kohlendioxid, Lipide und Cellulose verwendet. Die Verwendung von Cellulose ist vielversprechender, da Materialien wie Holz, Stroh, Abfallpapiere usw., Als Quelle für Cellulose -Rohstoff. Cellulose ist ein Glukosepolymer und kann als Quelle dieses Kohlenhydrats verwendet werden.
Toxizität und Risiken
 In einer Konzentration von 70%-90%finden sich hausgemachte Alkoholboote in der Regel
In einer Konzentration von 70%-90%finden sich hausgemachte Alkoholboote in der Regel Inhalation
Hohe Konzentrationen an Ethanoldampf können Schläfrigkeit, Augenreizungen und obere Atemwege verursachen, die sich durch Husten und Kopfschmerzen manifestieren.
Direkter Kontakt mit Haut und Augen
Hautkontakt kann Trockenheit und chronische, Reizung und Dermatitis verursachen. In der Zwischenzeit erzeugt Augenkontakt Reizungen, Rötungen, Schmerzen und brennendes Gefühl.
Einnahme
Erzeugt ein brennendes Gefühl und hat zunächst eine anregende und angenehme Wirkung aufgrund der enthemmelten Enthemmung. Aber wenn die Alkoholkonsum fortgesetzt wird, gibt es eine Nervendepression, Kopfschmerzen, verschwommene Sicht, Schläfrigkeit und Bewusstlosigkeit.
Chronische Effekte
Ethanol beeinflusst das Zentralnervensystem und die obere Atemwege. Darüber hinaus kann der durch Ethanolaufnahme verursachte Leberschäden zu Zirrhose und anschließend zum Tod führen.
Verweise
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. (10th Auflage.). Wiley Plus.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Morrison und Boyd. (1987). Organische Chemie. (Fünfte Ausgabe). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Ethanol. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologie Information. (2020). Ethanol. Pubchem Comunund -Zusammenfassung für CID 702. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Ethanolgeschichte. (2011). Ethanolgeschichte - von Alkohol bis hin zu Autobrennstoff. Erholt von: Ethanolhistory.com
- Die Herausgeber von Enyclopaedia Britannica. (2020). Ethanol. Erholt von: Britannica.com
- Korrekt. (15. Oktober 2000). Ethylalkohol für Sicherheitslaken (MSDS). [PDF]. Erholt von: iio.Ens.UABC.mx
- Byju. (2020). Verwendung von Methanol und Ethanol. Erholt von: Byjus.com
- Helmestine, Anne Marie, ph.D. (25. August 2020). Der Unterschied zwischen Alkohol und Ethanol. Erholt von: thoughtco.com

