Primärer Alkoholstruktur, Eigenschaften, Nomenklatur, Beispiele

- 4878
- 1501
- Joe Hartwig
A Hauptalkohol Es ist eines, in dem die Hydroxylgruppe mit einem primären Kohlenstoff verbunden ist. Dies ist ein kovalent gebundener Kohlenstoff an einen anderen Kohlenstoff und Wasserstoffe. Seine allgemeine Formel ist Roh, insbesondere RCH2Oh, da es nur eine Mietgruppe gibt r.
Die RCH -Formel R -Gruppe r2Oh, es kann jeder sein: eine Kette, ein Ring oder Heteroatome. Wenn es um eine Kette geht, kurz oder lang, liegt es vor den repräsentativsten primären Alkoholen. Unter ihnen sind Methanol und Ethanol, zwei der am stärksten synthetisierten auf industriellen Ebenen.
 Bierglas: Ein Beispiel für eine wässrige Lösung von Ethylalkohol, ein primärer Alkohol, in einer Bio -Matrix. Quelle: Engin Akyurt über Pxels.
Bierglas: Ein Beispiel für eine wässrige Lösung von Ethylalkohol, ein primärer Alkohol, in einer Bio -Matrix. Quelle: Engin Akyurt über Pxels. Physisch sind sie wie andere Alkohole, und ihre Kochen- oder Fusionspunkte hängen von dem Grad ihrer Auswirkungen ab. Aber chemisch sind sie am reaktivsten. Darüber hinaus ist seine Säure der sekundären und tertiären Alkohole überlegen.
Primäre Alkohole erleben Oxidationsreaktionen und werden zu einer Vielzahl von organischen Verbindungen: Ester und Ether, Aldehyde und Carbonsäuren. Sie können auch Dehydrationsreaktionen leiden und zu Alkenen oder Olefinen werden.
[TOC]
Struktur eines primären Alkohols
Primäre Alkohole aus linearen Alkanen sind die repräsentativsten. In Wirklichkeit kann jedoch jede Struktur, ob linear oder verzweigt, innerhalb dieser Art von Alkoholen klassifiziert werden, solange die OH -Gruppe mit einem CH verbunden ist2.
So hat strukturell jeder gemeinsam das Vorhandensein der Gruppe -ch2Oh, Methylol genannt. Ein Merkmal und Folge dieser Tatsache ist, dass die OH -Gruppe weniger verhindert wird; Das heißt, es kann mit der Umgebung interagieren, ohne dass andere Atome räumlich behindern.
Auch ein weniger verhindertes OH bedeutet, dass das Kohlenstoffatom, das es trägt, die Wahl2, kann Ersatzreaktionen durch einen SN -Mechanismus leiden2 (Bimolekular, ohne die Bildung einer Carbokation).
Andererseits führt ein OH mit größerer Freiheit, mit der Umwelt zu interagieren.
Es kann Ihnen dienen: Nickelhydroxid (III): Struktur, Eigenschaften, Verwendungen, RisikenEs geschieht auch mit seiner Löslichkeit in polaren Lösungsmitteln, solange die Gruppe R nicht sehr hydrophob ist.
Eigenschaften
Säure
Primäralkohole stammen von all den sauersten. Damit sich ein Alkohol wie eine BRNSTED -Säure verhalten kann, muss ein Ion H spenden+ in der Mitte, um Wasser zu sagen, ein Alcoxid -Anion zu werden:
Roh + h2GOLD- + H3ENTWEDER+
Die negative Last des Rotes-, speziell der RCH2ENTWEDER-, Fühle weniger Abstoßung der Elektronen der beiden C-H-Bindungen als durch die Elektronen der C-R-Bindung.
Die Mietgruppe übt dann die größte Abstoßung aus und destabilisiert RCH2ENTWEDER-; Aber nicht so sehr im Vergleich zu der Tatsache, dass bei zwei oder drei R -Gruppen, wie es bei sekundären bzw. tertiären Alkohols der Fall ist, der Fall ist.
Eine andere Möglichkeit, die größte Säure eines primären Alkohols zu erklären, ist der Unterschied in der Elektronegativität und erzeugt den Dipolmoment: H2Cδ+-ENTWEDERδ-H. Sauerstoff zieht die elektronische Dichte an, beide von CH2 ab H; Die positive partielle Belastung von Kohlenstoff stellt ein Stück Wasserstoff ab.
Gruppe R überträgt ein wenig von ihrer elektronischen Dichte an Cho2, Dies hilft, seine positive Teillast und damit seine Abstoßung für die Wasserstoffladung zu verringern. Je mehr RA -Gruppen, desto niedriger die Abstoßung und damit der Trend von H als H freigesetzt werden+.
PKA
Primäre Alkohole werden als schwächste Säuren als Wasser angesehen, mit Ausnahme von Methylalkohol, der etwas stärker ist. Die PKA von Methylalkohol beträgt 15,2; Und die PKA von Ethylalkohol ist 16,0. Inzwischen ist das Wasser PKA 15,7.
Wasser, das wie Alkohole als schwache Säure angesehen wird+ Sich in das Hydrium -Ion verwandeln, h3ENTWEDER+; Das heißt, es verhält sich wie eine Basis.
Auf die gleiche Weise können primäre Alkohole Wasserstoff einfangen. Besonders in einigen der Reaktionen, die ihre eigenen sind, zum Beispiel bei ihrer Umwandlung in Alkene oder Olefines.
Chemische Reaktionen
Mieten Sie Halogenuros Formation
Alkohole reagieren mit Wasserstoffhalogeniden, um Alkylhalogenide zu produzieren. Die Reaktivität der Alkohole vor den Wasserstoffhalogeniden steigt in der folgenden Reihenfolge ab:
Kann Ihnen dienen: KohlenstoffTertiäralkohol> Sekundärer Alkohol> Primäralkohol
Roh +hx => rx +h2ENTWEDER
RX ist ein primäres Alkylhalogenid (wählen3Cl, Ch3CH2Br usw.).
Eine andere Möglichkeit zur Herstellung von Alkyl -Halogenuros ist die Reaktion von Tionilo -Chlorid, einem synthetischen Reagenz, mit einem primären Alkohol, der zu Alkylchlorid wird. Tionilo -Chlorid (Socl2) Erfordert, das Vorhandensein von Pyridin zu reagieren.
CH3(CH2)3CH2Oh +Socl2 => Ch3(CH2)3CH2Cl +so2 + HCl
Diese Reaktion entspricht der Halogenierung von 1-Penol, um 1-Cloropentano in Gegenwart von Pyridin zu werden.
Oxidation von primären Alkoholen
Alkohole können je nach Reagenz zu Aldehyden und Carbonsäuren oxidiert werden. Pyridiniumchlorochromat (PCC) oxidiert primärem Alkohol zu Aldehyd unter Verwendung des Dichlormethans als Lösungsmittel (CH2Cl2):
CH3(CH2)5CH2Oh => cho3(CH2)5Coh
Dies ist die Oxidation von 1-Heptanol in 1-Heptanal.
Inzwischen Kaliumpermanganat (KMNO4) Alkoholalkohol zuerst und dann zum Aldehyd zu Carbonsäure oxidiert. Wenn das Kaliumpermanganat zum Oxidieren von Alkoholen verwendet wird, sollte das Brechen des Zusammenhangs zwischen Kohlenstücken 3 und 4 vermieden werden.
CH3(CH2)4CH2Oh => cho3(CH2)4Cooh
Dies ist die Oxidation von 1-Hexanol zu Hexansäure.
Nach dieser Methode ist es schwierig, einen Aldehyd zu erhalten, da es leicht eine Carboxylsäure oxidiert. Eine ähnliche Situation wird beobachtet, wenn Chromsäure verwendet wird, um Alkohole zu oxidieren.
E éteres Formation
Primäre Alkohole können zu Ether werden, wenn sie in Gegenwart eines Katalysators erhitzt werden, normalerweise Schwefelsäure:
2 rch2Oh => rch2Och2R +h2ENTWEDER
Organische Esaresbildung
Die Kondensation eines Alkohols und einer Carboxylsäure, die durch eine Säure katalysierte Fischereiserie, erzeugt ein Ester und Wasser:
Kann Ihnen dienen: Carbokation: Bildung, Eigenschaften, Typen, StabilitätR'oh +rcooh rcoor ' +h2ENTWEDER
Eine gut bekannte Reaktion ist die von Ethanol mit Essigsäure, um Ethylacetat zu geben:
CH3CH2OH +CH3Cooh ch3Coohch2CH3 + H2ENTWEDER
Primärer Alkohol ist am anfälligsten für Fischer -Sterifizierungsreaktionen.
Dehydration
Bei hohen Temperaturen und in einem sauren Medium, normalerweise Schwefelsäure, dehydrieren Alkohole, um Alkene mit dem Verlust eines Wassermoleküls zu verursachen.
CH3CH2Oh => h2C = Ch2 + H2ENTWEDER
Dies ist die Dehydrationsreaktion von Ethanol auf Ethylen. Eine geeignetere allgemeine Formel für diese Art von Reaktion, insbesondere für einen primären Alkohol, wäre:
Rch2Oh => r = cho2 (Was ist auch gleich RC = ch2)
Nomenklatur
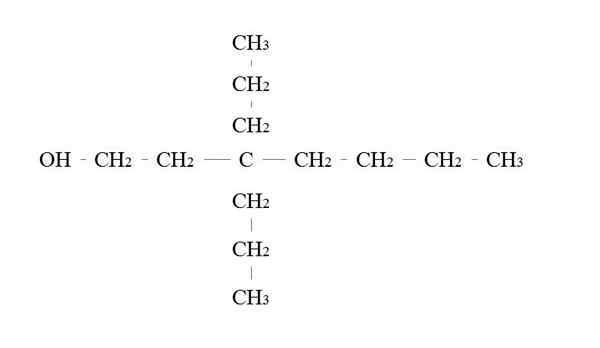 Beispiel für primäres Alkohol. Quelle: Gabriel Bolívar.
Beispiel für primäres Alkohol. Quelle: Gabriel Bolívar. Die Regeln, um einen primären Alkohol zu nennen, sind die gleichen wie bei den anderen Alkoholen. Mit Ausnahme, dass es manchmal nicht notwendig ist, den Träger des OH zu zählen.
Im oberen Bild befindet sich eine Hauptkette sieben Carbon. Mit dem OH verbundener Kohlenstoff wird die Anzahl 1 zugewiesen, und dann beginnt es von links nach rechts zu zählen. Sein IUPAC-Name ist daher: 3,3-Dietilheptanol.
Beachten Sie, dass dies ein Beispiel für einen hoch verzweigten Primäralkohol ist.
Beispiele
Schließlich werden einige primäre Alkohole nach ihrer traditionellen und systematischen Nomenklatur erwähnt:
-Methyl, Ch3Oh
-Ethyl, ch3CH2Oh
-N-Propyl, Ch3CH2CH2Oh
-N-hexyl, ch3CH2CH2CH2CH2CH2Oh
Diese stammen aus linearen Alkanen. Andere Beispiele sind:
-2-fenyletanol, c6H5CH2CH2Oh (c6H5 = Benzolring)
-2-propen-1-OC-OC (Allilic Alkohol), Cho2= CHCH2Oh
-1,2-taodiol, Ch2Ohch2Oh
-2-Chloretanol (Ethyleclorhydrin), CLCH2CH2Oh
-2-Buten-1-ol (Crotilalkohol), CH3CH = CHCH2Oh
Verweise
- Morrison, r.T. Und Boyd, r. N. (1987). Organische Chemie. (5ta Auflage). Addison-Wesley Iberoamericana
- Carey, f. ZU. (2008). Organische Chemie. (6ta Auflage). McGraw-Hill, Intermerica, Herausgeber s.ZU.
- Mel Science. (2019). Wie die Oxidation von primären Alkoholen stattfindet. Erholt von: Melscience.com
- Royal Society of Chemistry. (2019). Definition: Hauptalkohole. Erholt von: RSC.Org
- Chriss e. McDonald. (2000). Die Oxidation von primären Alkoholen zu Estern: drei verwandte Untersuchungsexperimente. J. Chem. Bildung., 2000, 77 (6), S. 750. Doi: 10.1021/ed077p750
- « Aktineigenschaften, Struktur, Filamente, Funktion
- Diamagnetismusmaterialien, Anwendungen, Beispiele »

