Tertiäralkoholstruktur, Eigenschaften, Beispiele
- 2161
- 506
- Medine Kedzierski
A Tertiäralkohol Es ist eines, in dem die Hydroxylgruppe, OH, mit einem tertiären Kohlenstoff verbunden ist. Seine Formel ist wie andere Alkohole weiterhin Roh; Aber es ist leicht zu erkennen, weil OH in der molekularen Struktur nahe an einem x liegt. Auch seine kohlensäurehaltige Kette ist normalerweise kürzer und ihre Hauptmolekülmasse.
Dann ist ein tertiärer Alkohol in der Regel schwerer, er ist mehr verzweigt und ist auch in Bezug auf die Oxidation am wenigsten reaktiv; Das heißt, es kann nicht in ein Ceton oder Carbonsäure umgewandelt werden, wie es bei sekundären bzw. primären Alkoholen auftritt.
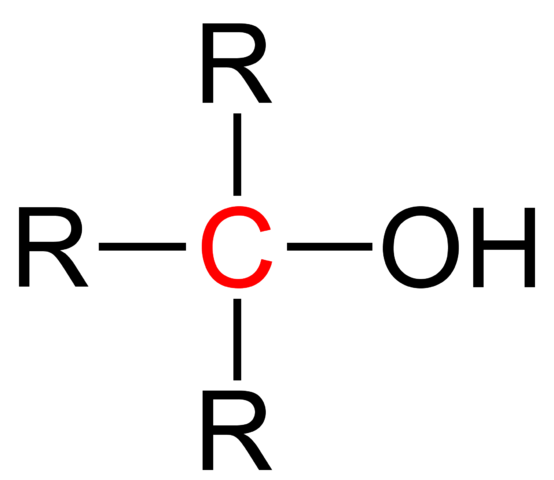
 Strukturformel eines tertiären Alkohols. Quelle: Jü [Public Domain].
Strukturformel eines tertiären Alkohols. Quelle: Jü [Public Domain]. Die allgemeine strukturelle Formel für einen tertiären Alkohol wird im oberen Bild gezeigt. Nach ihr könnte eine neue Formel vom R -Typ geschrieben werden3Coh, wo r eine Alkyl- oder Arylgruppe sein kann; Eine Methilo -Gruppe, CH3, oder eine kurze oder lange kohlensäurehaltige Kette.
Wenn die drei R -Gruppen unterschiedlich sind, ist der zentrale Kohlenstoff des tertiären Alkohols chiral; Das heißt, Alkohol wird optische Aktivitäten darstellen. Zu dieser Tatsache verlangen die tertiären quiralen Alkohole Interesse in der Pharmaindustrie, da diese Alkohole aus Ketonen mit biologischer Aktivität mit komplexeren Strukturen synthetisiert werden.
[TOC]
Struktur eines tertiären Alkohols
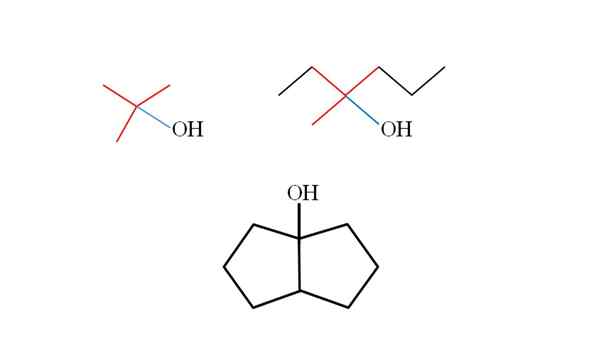 Drei tertiäre Alkohole und ihre Strukturen. Quelle: Gabriel Bolívar.
Drei tertiäre Alkohole und ihre Strukturen. Quelle: Gabriel Bolívar. Betrachten Sie die Strukturen der oberen Tertiäralkohole, um zu lernen, sie unabhängig von der Verbindung zu erkennen. Der mit OH verbundene Kohlenstoff muss ebenfalls mit drei anderen Kohlenstoffen verbunden sein. Wenn es im Detail beobachtet wird, entsprechen die drei Alkohole dies.
Der erste Alkohol (links) besteht aus drei Gruppen CH3 Central Carbon verknüpft, dessen Formel (Cho sein würde3)3Coh. Die Mietgruppe (wählen3)3C- Es ist als tertbutil bekannt.
Es kann Ihnen dienen: Potentiometer (Phameter)Der zweite Alkohol (rechts) hat den zentralen Carbon Lin3, CH3CH2 und Ch2CH2CH3. Da die drei Gruppen unterschiedlich sind, ist Alkohol chiral und weist daher optische Aktivitäten auf. Ein t wird hier nicht beobachtet, sondern ein X in der Nähe von OH (rot und blau).
Und im dritten Alkohol (die unten und ohne Farben) ist das OH mit einem der beiden Kohlenstoffe verbunden, die sich zwei Cyclopentano anschließen. Dieser Alkohol zeigt keine optische Aktivität, da zwei der zentralverbundenen Gruppen identisch sind. Wie der zweite Alkohol wird auch ein X (eher ein Tetraeder) gefunden, wenn er sorgfältig beobachtet wird.
Sterische Hindernis
Die drei überlegenen Alkohole haben etwas gemeinsamer als ein X: Zentralkohlenstoff wird sterisch verhindert; Das heißt, es gibt viele Atome, die ihn im Weltraum umgeben. Eine unmittelbare Folge davon ist, dass Nucleophile, die nach positiven Ladungen bestreiten sind, Schwierigkeiten haben, sich diesem Kohlenstoff zu nähern.
Auf der anderen Seite spenden sie drei Kohlenstoff, die mit dem zentralen Kohlenstoff verbunden sind, einen Teil der elektronischen Dichte, als das elektronegative Atom von Sauerstoff sie subtrahiert und es noch mehr vor diesen nukleophilen Angriffen stabilisiert. Tertiäralkohol kann jedoch durch die Bildung von Carbocation erleiden.
Eigenschaften
Physisch
Die 3. Alkohole haben im Allgemeinen hoch verzweigte Strukturen. Eine erste Folge davon ist, dass die OH -Gruppe verhindert wird, und daher wirkt ihr Dipolmoment einen geringfügigen Effekt auf benachbarte Moleküle aus.
Dies führt zu schwächeren molekularen Wechselwirkungen im Vergleich zu denen von primären und sekundären Alkoholen.
Kann Ihnen dienen: Le châtelier PrinzipBetrachten Sie beispielsweise die strukturellen Isomere von Butanol:
CH3CH2CH2Oh (N-Butanol, Peb = 117ºC)
(CH3)2CH2OH (isobutiler Alkohol, Peb = 107ºC)
CH3CH2Ch (oh) ch3 (Sekbutil Alkohol, Peb = 98ºC)
(CH3)3COH (tertbutiler Alkohol, Peb = 82ºC)
Beachten Sie, wie Siedepunkte absteigen, wenn das Isomer mehr verzweigt wird.
Zunächst wurde erwähnt, dass in den Strukturen von Alkohols 3 ein x beobachtet wird, was an sich einen hohen Zweig anzeigt. Deshalb haben diese Alkohole tendenziell geringere Schmelz- und/oder Siedepunkte.
Etwas ähnlich ist für Ihre Mischbarkeit mit Wasser der Fall. Je mehr verhinderte. Diese Mischbarkeit verringert jedoch, je länger die Kohlenstoffkette; Somit ist thermischer Alkohol löslicher und mischbarer mit Wasser als die N-Butanol.
Säure
Tertiäralkohole sind in der Regel die geringsten Säuren von allen. Die Gründe sind zahlreich und beziehen sich aufeinander. In summarischen Konten hat die negative Belastung seines abgeleiteten Alcoxids rot-, Sie werden eine starke Abstoßung für die drei mit dem zentralen Kohlenstoff verbundenen Alkalgruppen spüren und den Anion schwächen.
Je instabiler das Anion ist, desto weniger die Säure von Alkohol sein wird.
Reaktivität
3. Alkohole können keine Oxidationen für Ketone leiden (R. R2C = o) oder Aldehydos (rcho) oder carboxylsäuren (rcooh). Einerseits müsste ich ein oder zwei Kohlenstoffe verlieren (in Form von CO2) zu oxidieren, was seine Reaktivität gegen Oxidation verringert; Auf der anderen Seite fehlt es Wasserstoff, der verlieren kann, um einen weiteren Zusammenhang mit Sauerstoff zu bilden.
Es kann Ihnen dienen: Pyridin: Struktur, Eigenschaften, Verwendung, Toxizität, SyntheseSie können jedoch Substitution und Eliminierung erleiden (Bildung einer Doppelbindung, eines Alkens oder Olefin).
Nomenklatur
Die Nomenklatur für diese Alkohole ist nicht anders als die anderer. Es gibt gemeinsame oder traditionelle Namen und die systematischen Namen der IUPAC.
Wenn die Hauptkette und ihre Auswirkungen aus einer anerkannten Mietgruppe bestehen, wird sie für ihren traditionellen Namen verwendet. Wenn dies nicht möglich ist, wird die IUPAC -Nomenklatur verwendet.
Betrachten Sie beispielsweise den folgenden tertiären Alkohol:
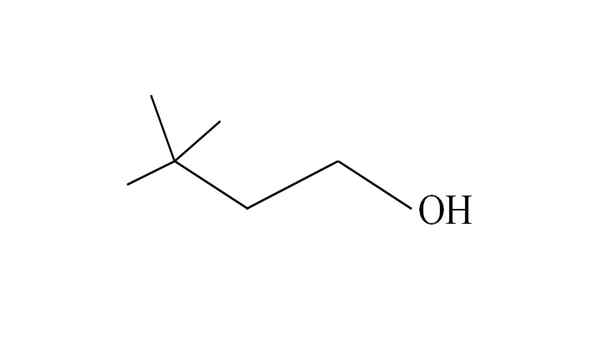 3,3-Dimethyl-1-Butanol. Quelle: Gabriel Bolívar.
3,3-Dimethyl-1-Butanol. Quelle: Gabriel Bolívar. Es beginnt, Kohlenstoffe von rechts nach links aufzählen. In der C-3 gibt es zwei Gruppen CH3 von Substituenten, und daher ist der Name dieses Alkohols 3,3-Dimethyl-1-Butanol (die Hauptkette hat vier Kohlenstoffe).
Ebenso bestehen die gesamte Kette und ihre Auswirkungen aus der Neohexilo -Gruppe; Daher kann sein traditioneller Name Neohexylalkohol oder Neohexanol sein.
Beispiele
Schließlich werden einige Beispiele für tertiäre Alkohole erwähnt:
-2-Methyl-2-Propanol
-3-Methyl-3-Hexanol
-Biciclo [3,3,0] octan-1-ol
-2-Methyl-2-Butanol: Ch3CH2Coh (ch3)2
Die Formeln der ersten drei Alkohole sind im ersten Bild dargestellt.
Verweise
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Morrison, r. T. und Boyd, r, n. (1987). Organische Chemie. (5. Ausgabe). Editorial Addison-Wesley Interamerikaner.
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. Amine. (10. Ausgabe.). Wiley Plus.
- Gunawardena Gamini. (31. Januar 2016). Tertiäralkohol. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Ashenhurst James. (16. Juni 2010). Alkohole (1) - Nomenklatur und Eigenschaften. Erholt von: Masterorganicchemistry.com
- Clark j. (2015). Alkohole einführen. Erholt von: Chemguide.CO.Vereinigtes Königreich
- Organische Chemie. (S.F.). Thema 3. Alkohole. [PDF]. Erholt von: Sinorg.Uji.Ist
- Nilanjana majumdar. (3. März 2019). Synthese von chiralem Tertiäralkohol: bedeutende Entwicklungen. Geborgen von: 2.Chemie.MSU.Edu
- « Formative Periode of America Ursprung, Merkmale, Produkte
- Wie war die europäische Gesellschaft in der ersten Hälfte des neunzehnten Jahrhunderts? »

