Aldehyde
- 812
- 16
- Nick Laurén
Was sind die Aldehyde?
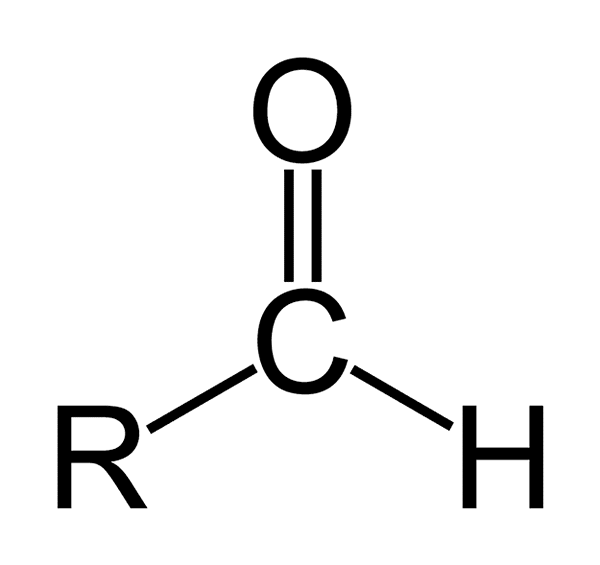
Der Aldehyde Sie sind organische Verbindungen mit einer allgemeinen Formel -RCHO. R repräsentiert eine aliphatische oder aromatische Kette; C Kohlenstoff; Oder Sauerstoff- und H -Wasserstoff. Sie sind durch Besitz einer Carbonylgruppe wie Ketonen und Carbonsäuren gekennzeichnet, sodass Aldehyde auch als Carbonylverbindungen bezeichnet werden.
Die Carbonylgruppe gibt dem Aldehyd viele ihrer Eigenschaften. Sie sind Verbindungen, die leicht oxidiert werden und sehr reaktiv auf nukleophile Ergänzungen sind. Die Doppelbindung der Carbonylgruppe (C = O) zeigt zwei Atome, die Unterschiede in ihrer Avidität durch Elektronen (Elektronegativität) aufweisen.
Sauerstoff zieht Elektronen stärker als Kohlenstoff an, so. Dies macht den Aldehydos.
Mit anderen Worten, Aldehydos sind eine Art organische Verbindungen, die sich aus der Oxidation bestimmter Alkohole ergeben.
Chemische Struktur der Aldehydos
 Chemische Struktur der Aldehydos
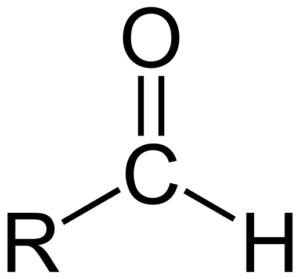
Chemische Struktur der Aldehydos Die Aldehydos bestehen aus einer Carbonyl (c = o), mit der ein Wasserstoffatom direkt miteinander verbunden ist. Dies unterscheidet es von anderen organischen Verbindungen wie Ketonen (R. R2C = O) und Carboxsäuren (RCOOH).
Das obere Bild zeigt die molekulare Struktur um das Gruppenformil -CHO, das Formil. Die Formilgruppe ist flach, weil Kohlenstoff und Sauerstoff SP -Hybridisierung aufweisen2. Diese Planarität macht sie anfällig für den Angriff von Nucleophilenspezies und ist daher leicht oxidiert.
Was bedeutet eine solche Oxidation?? Zur Bildung einer Verbindung mit einem anderen elektronegativeren Atom als Kohlenstoff; Und im Fall von Aldehydos ist es ein Sauerstoff. Somit oxidiert der Aldehyd eine Carbonsäure, -coh. Was wäre, wenn der Aldehyd reduziert wäre? Stattdessen würde ein primärer Alkohol gebildet, Roh.
Aldehydos treten nur aus primären Alkoholen auf: diejenigen, in denen sich die OH -Gruppe am Ende einer Kette befindet. In ähnlicher Weise die Formilgruppe stets Es liegt am Ende einer Kette oder hebt sich von ihm oder dem Ring als Substituent ab (wenn es andere wichtigere Gruppen gibt, wie -COOH).
Physikalische und chemische Eigenschaften der Aldehyde
Als polare Verbindungen sind ihre Schmelzpunkte größer als die von nicht -polaren Verbindungen. Aldehydos -Moleküle sind nicht in der Lage, intermolekular durch Wasserstoffbrücken zu binden, weil nur Kohlenstoffatome an Wasserstoffatomen vereint sind.
Aufgrund der oben genannten haben Aldehyde niedrigere Siedepunkte als Alkohole und Carbonsäuren.
Fusionspunkte
Formaldehyd -92; Acetaldehyd -121; Propionaldehyd -81; N -Butiraldehyd -99; N -Valeraldehyd -91; Kaproaldehyd -; Heptaldehyd - 42; Phenylacetaldehyd -; Benzaldehyd -26.
Siedepunkte
Formaldehyd -21; Acetaldehyd 20; Propionales Ofhyd 49; N-Butiraldehido 76; N-Valeraldehyd 103; Kaproaldehyd 131; Heptaldehyd 155; Phenylacetaldehyd 194; Benzaldehyd 178.
Kann Ihnen dienen: Spezifische Eigenschaften der Materie: Was sind und Beispiele und BeispieleWasserlöslichkeit in g/100 g von H2ENTWEDER
Formaldehyd, sehr löslich; Acetaldehyd, unendlich; Propionaldehyd, 16; N-Butiraldehyd, 7; N-Valeraldehyd, leicht löslich; Kaproaldehyd, leicht löslich; Phenylacetaldehyd leicht löslich; Benzaldehyd, 0,3.
Die Siedepunkte der Aldehydos neigen dazu, direkt mit dem Molekulargewicht zu steigen. Im Gegenteil, es besteht die Tendenz, die Löslichkeit von Aldehyden im Wasser zu verringern, wenn ihr Molekulargewicht zunimmt. Dies spiegelt sich in den physikalischen Konstanten der neu erwähnten Aldehyde wider.
Reaktivität der Aldehydos
Oxidationsreaktion
Aldehyde können die entsprechende Carbonsäure in Gegenwart dieser Verbindungen oxidieren: Ag (NH3)2, Kmno4 Okay2Cr2ENTWEDER7.
Reduzierung von Alkoholen
Sie können sich mit Hilfe von Nickel-, Platin- oder Paladiumkatalysatoren - Wasserstoffe. Somit wird C = o in C-OH transformiert.
Reduktion von Kohlenwasserstoffen
In Gegenwart von Zn (Hg), konzentrierter HCl oder in NH2NH2 Die Aldehydos verlieren die Carbonylgruppe und werden Kohlenwasserstoffe.
Nukleophile Zugabe
Es gibt mehrere Verbindungen, die der Carbonylgruppe zugesetzt werden, darunter: Grignard, Cyanidreagenzien, Ammoniakderivate und Alkohole.
Nomenklatur der Aldehydos
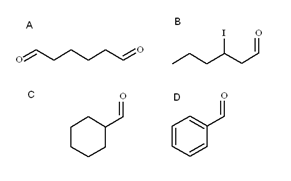 Vier Aldehyde. Quelle: Gabriel Bolívar
Vier Aldehyde. Quelle: Gabriel Bolívar Im überlegenen Bild werden vier Aldehydos veranschaulicht. Wie werden sie benannt?
Da es sich um rostige primäre Alkohole handelt, wird der Name des Alkohols die Kündigung -ol durch -al geändert. So Methanol (wählen3OH), wenn er zu Cho oxidiert wird3Cho heißt Metanal (Formaldehyd); CH3CH2Cho Etanal (Acetaldehyd); CH3CH2CH2Cho Propanal und Cho3CH2CH2CH2Butanal Cho.
Alle neu genannten Aldehydos haben die Gruppe -SCH am Ende der Kette. Wenn dies an beiden Enden liegt, wie in a am Ende -wird ihm das Präfix DI hinzugefügt-. Ebenso wie sechs Kohlenstoffe (zählt die beider Formylgruppen), es stammt aus 1-Hexanol und der Name ist daher: Hexanwählen.
Wenn es einen Substituenten wie ein alquilisches Radikal, ein doppelter oder dreifacher Glied oder ein Halogen gibt, werden Kohlenstoffe der Hauptkette aufgeführt, indem die Nummer 1 angegeben wird. Somit heißt Aldehyd B: 3-oodhexanal.
In den Aldehyden C und D hat die Gruppe -SCH jedoch keine Priorität, diese Verbindungen anderer zu identifizieren. C ist ein Cycloalcano, während D a Benzol, beide mit einem von H durch eine Formilgruppe ersetzt werden.
In ihnen heißt die Formilgruppe, da die Hauptstruktur zyklisch ist. Daher ist C das Cyclohexanocbaldehyd und D der Benzenocarbaldehyd (besser bekannt als Benzaldehyd).
Verwendung von Aldehydos
Es gibt Aldehyde in der Natur, die in der Lage ist, angenehme Aromen zu verleihen. Dies ist der Fall des Zimtes, der für den charakteristischen Geschmack von Zimt verantwortlich ist. Deshalb werden sie normalerweise als künstliche Aromen in vielen Produkten wie Süßigkeiten oder Lebensmitteln verwendet.
Formaldehyd
Der Formaldehyd ist der Aldehyd, der industriell in größerer Menge auftritt. Der Formaldehyd, der durch die Oxidation von Methanol erhalten wird. Dies wird beim Bräunen von Skins und in der Erhaltung und Einbalsamierung von Leichen verwendet.
Kann Ihnen dienen: Natriumacetat: Struktur, Eigenschaften, Synthese, verwendetDer Formaldehyd wird auch als Germizid, Fungizid und Insektizid für Pflanzen und Gemüse verwendet. Der größte Nutzen ist jedoch der Beitrag zur Herstellung von Polymermaterial. Der Kunststoff, der Bakelita bezeichnet wird, wird durch die Reaktion zwischen Formaldehyd und Phenol synthetisiert.
Bakelita
Bakelita ist ein großes, hartes, dimensionales Strukturpolymer, das in zahlreichen Hausutensilien wie Töpfen aus Töpfen, Pfannen, Kaffeemaschinen, Messern usw. verwendet wird.
Polymere ähnlich wie Bakelita werden aus Formaldehyd in Kombination mit Harnstoff- und Melaminverbindungen hergestellt. Diese Polymere werden nicht nur als Kunststoffe verwendet, sondern auch als Klebstangen und Beschichtungsmaterial verwendet.
Sperrholz
Das Sperrholz ist der kommerzielle Name eines Materials, das durch dünne Holzblätter gebildet wird und durch Polymere, die aus dem Formaldehyd hergestellt werden. Formik- und Melmac -Marken werden mit der Beteiligung davon hergestellt. Die Formik ist ein Kunststoffmaterial, das in der Möbelbeschichtung verwendet wird.
MMLMAC -Kunststoff wird zur Ausarbeitung von Platten, Brillen, Tassen usw. verwendet. Der Formaldehyd ist Rohstoff für die Synthese der Methylen-DIfenil-Diisocianat (MDI).
Polyurethan
Das Polyurethan wird als Isolator in Kühlschränken und Gefriergeräten verwendet, gepolstert für Möbel, Matratzen, Beschichtungen, Klebstoffe, Sohlen usw.
Butiraldehyd
Butiraldehyd ist der Hauptvorläufer für die Synthese von 2-Ethylhexanol, das als Weichmacher verwendet wird. Es hat ein angenehmes Apfelaroma, das seine Verwendung in Lebensmitteln als Aroma ermöglicht.
Es wird auch für Gummibeschleuniger verwendet. Es greift als Zwischenreagenz bei der Herstellung von Lösungsmitteln ein.
Acetaldehyd
Acetaldehyd wurde in der Essigsäureproduktion verwendet. Diese Funktion von Acetaldehyd hat jedoch die Bedeutung verringert, da sie durch den Methanol -Carbonilatationsprozess vertrieben wurde.
Synthese
Andere Aldehyde sind Oxoalkohole -Vorläufer, die bei der Herstellung von Reinigungsmitteln verwendet werden. Die sogenannten Oxoalkohole werden durch Zugabe von Kohlenstoff und Wasserstoffmonoxid zu einem Olefin hergestellt, um einen Aldehyd zu erhalten. Und schließlich ist der Aldehyd Wasserstoff, um Alkohol zu erhalten.
Einige Aldehydos werden zur Herstellung von Parfums wie dem Chanel Nr. 5 verwendet. Viele natürliche Aldehyde haben angenehme Gerüche, zum Beispiel: Heptanal hat den Geruch von grünem Gras; das Octanal, Geruch von Orange; Der Nichtanal, Geruch von Rosen und Zitral, Geruch von Lima.
Beispiele für Aldehyde
Glutaraldehyd
 Glutaraldehyd. Quelle: von Jynto [CC0] aus Wikimedia Commons
Glutaraldehyd. Quelle: von Jynto [CC0] aus Wikimedia Commons Glutaraldehyd präsentiert in seiner Struktur zwei Formylgruppen an beiden Enden.
Unter dem Namen Cidex oder Glutararal vermarktet, wird es als Desinfektionsmittel verwendet, um chirurgische Instrumente zu sterilisieren. Es wird bei der Behandlung von Warzen an den Füßen verwendet, die als Flüssigkeit auftragen.
Es wird auch als Stofffixiermittel in Histologie- und Pathologie -Labors verwendet.
Es kann Ihnen dienen: Kupfersulfat (CUSO4): Struktur, Eigenschaften, erhalten, verwendet, verwendetBenzaldehyd
Es ist der einfachste aromatische Aldehyd, der durch einen Benzolring gebildet wird, an dem eine Formilgruppe miteinander verbunden ist.
Es ist in Mandelöl zu finden, daher sein charakteristischer Geruch, der seine Verwendung als Lebensmittelaroman ermöglicht. Darüber hinaus wird es zur Synthese organischer Verbindungen verwendet.
Glyceraldehyd
Es ist ein Aldotriosa, ein Zucker, der aus drei Kohlenstoffatomen besteht. Es präsentiert zwei Isomere, die D- und L -Enantiomere genannt werden. Glyceraldehyd ist das erste Monosaccharid, das während der Dunkelphase in der Photosynthese erhalten wurde (Calvin -Zyklus).
Glyceraldehyd-3-phosphat
 Glyceraldehyd. Quelle: Jynto und Ben Mills
Glyceraldehyd. Quelle: Jynto und Ben Mills Im überlegenen Bild wird die Struktur des Glyceraldehyd-3-phosphat veranschaulicht. Die roten Kugeln neben dem Gelb entsprechen der Phosphatgruppe, während schwarz zum Kohlenstoffskelett. Die mit dem Blanca verbundene rote Kugel ist die OH -Gruppe, aber wenn die schwarze Kugel miteinander verbunden ist und letztere mit dem weißen ist, dann ist es die Cho -Gruppe.
Glyceraldehyd-3-phosphat interveniert die Glykolyse, ein Stoffwechselprozess, bei dem Glucose mit der Produktion von ATP, einem Energiespeicher von Lebewesen, zu Pyruvsäure abgebaut wird. Neben der Produktion von NADH ist ein biologischer Reduktionsmittel.
In Glykoleraldehyd-3-phosphatglykolyse und Phosphatdihydroaceton werden durch das D-FRUCEASE-6-6-BIPHARY-FOSPOSPATON verursacht.
Der Glyceraldehyd-3-Phosphat interveniert im Stoffwechselprozess als Pentosezyklus. Darin wird der NADPH erzeugt, wichtige biologische Reduziererin.
11 -cis -retinal
 11 -cis -retinal
11 -cis -retinal Β-Carotin ist ein natürliches Pigment, das in mehreren Gemüse vorhanden ist, insbesondere in der Karotte. Erleben Sie einen oxidativen Bruch in der Leber, wodurch sich Retinolalkohol oder Vitamin A verändert. Die Oxidation von Vitamin A und die anschließende Isomerisierung einer seiner Doppelbindungen bildet den 11-CIS-Retinal-Aldehyd.
Pyridoxalphosphat (Vitamin B6)
 Pyridoxalphosphat oder Vitamin B6. Quelle: Jynto und Ben Mills.
Pyridoxalphosphat oder Vitamin B6. Quelle: Jynto und Ben Mills. Es handelt sich um eine prothetische Gruppe, die an mehrere Enzyme gebunden ist, die die aktive Form von Vitamin B6 ist und am Syntheseprozess des inhibitorischen Neurotransmitters GABA beteiligt ist.
Wo ist die Formilgruppe in ihrer Struktur?? Beachten Sie, dass dies vom Rest der Gruppen unterscheidet, die mit dem aromatischen Ring verbunden sind.
Salicilaldehyd
Es ist ein Rohstoff für die Synthese von Acetylsalicylsäure, analgetischem und antipyretisch.
Verweise
- Robert c. Neuman, jr. Kapitel 13, Carbonylverbindungen: Ketone, Aldehyde, Carbonsäuren. [PDF]. Genommen von: Chem.UCR.Edu
- Germán Fernández. (14. September 2009). Nomenklatur der Aldehydos. Entnommen aus: Chemicicaorganica.Netz
- T.W. Graham Solomons, Craight B. Braten. Organische Chemie. (Zehnte Ausgabe, S. 729-731) Wiley Plus.
- Jerry March und William H. Braun. (31. Dezember 2015). Aldehyd. Entnommen aus: Britannica.com
- Wikipedia. (2018). Aldehyde. Entnommen aus: https: // in.Wikipedia.org/wiki/Aldehyd
- Morrison, r. T. Und Boyd, r. N. (1990). Organische Chemie fünfte Ausgabe. Editorial Addison-Wesley Iberoamericana.
- Carey, f. ZU. (2006). Organische Chemie sechste Ausgabe. MC Graw Hill Editorial.
- Mathews, Ch. K., Van Holde, K. UND. Und Athern, k. G. (2002). Biochemie. Dritte Edition. Editorial Pearson Adisson Wesley.

