Alfa Amilasa -Eigenschaften, Struktur, Funktionen
- 3721
- 680
- Luca Holdt
Der Alfa Amilasa (α-Amylase) ist ein amilolithisches Enzym der Endo-Amilasas-Gruppe, das für die Hydrolyse der α-1,4-Bindungen zwischen den Glukoseresten verantwortlich ist.
Systematisch als systematisch bezeichnet als α-1,4-Glucan. Beim Menschen zum Beispiel sind die im Speichel vorhandenen Amylasen und die von der Bauchspeicheldrüse abgesonderten α-Amylasen-Typ.
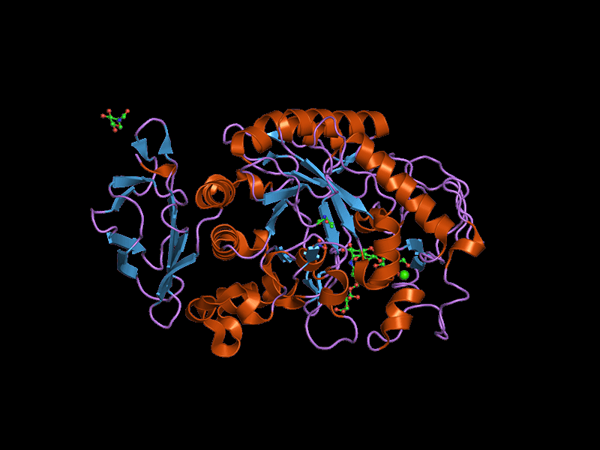
 C-terminale Domänenstruktur des Alfa Amilasa-Tieres (Quelle: Jawahar Swaminathan und MSD-Mitarbeiter des Europäischen Bioinformatikinstituts [Public Domain] über Wikimedia Commons) über Wikimedia Commons)
C-terminale Domänenstruktur des Alfa Amilasa-Tieres (Quelle: Jawahar Swaminathan und MSD-Mitarbeiter des Europäischen Bioinformatikinstituts [Public Domain] über Wikimedia Commons) über Wikimedia Commons) Kuhn, 1925, war der erste, der den Begriff "α-Amylase" auf der Grundlage der Tatsache machte, dass die katalysierenden Produkte der Hydrolyse, die diese Enzyme katalysieren, Konfiguration α aufweisen. Später, im Jahr 1968.
Wie andere amilolithische Enzyme ist α-Amylase für die Hydrolyse der Stärke und andere verwandte Moleküle wie Glykogen verantwortlich, wodurch kleinere Polymere aus wiederholten Glucoseeinheiten erzeugt werden.
Zusätzlich zu den physiologischen Funktionen, die dieses Enzym in Tieren, Pflanzen und Mikroorganismen hat, die es exprimieren, sind α-Amylase zusammen mit den anderen Klassen vorhandener Amylasen 25% der für industriellen und biotechnologischen Zwecke verwendeten Enzyme aktueller Marktmarkt.
Viele Arten von Pilzen und Bakterien sind die Hauptquelle für die Erlangung der α-Amylasen, die häufiger in der Industrie und im wissenschaftlichen Experimentieren verwendet werden. Dies ist hauptsächlich auf die Vielseitigkeit, die einfache Erlangung, sein einfaches Management und die niedrigen Kosten im Zusammenhang mit seiner Produktion zurückzuführen.
[TOC]
Eigenschaften
Die in der Natur gefundenen α-Amylasen können optimale pH-Bereiche von sehr unterschiedlichem pH-Wert für seine Operation aufweisen. Zum Beispiel ist optimal für α-Amylasen-Tiere und Pflanzen zwischen 5.5 und 8.0 pH -Einheiten, aber einige Bakterien und Pilze haben mehr alkalische Enzyme und mehr Säure.
Kann Ihnen dienen: PhylogenieDie in Speichel und Säugetier -Bauchspeicheldrüse vorhandenen Enzyme funktionieren zusätzlich bei pH -Wert bei pH nahe 7 (neutral).
Sowohl Tiere, Speichel- als auch Pankreasenzyme werden in Organismen von unabhängigen Mechanismen produziert, die spezifische Zellen und Drüsen betreffen und die wahrscheinlich nicht mit den Enzymen zusammenhängen.
Sowohl der pH -Wert als auch die optimale Temperatur für die Funktion dieser Enzyme hängen stark von der Physiologie des in Betracht gezogenen Organismus ab, da es extremophile Mikroorganismen gibt, die in sehr bestimmten Bedingungen in Bezug auf diese und viele andere Parameter wachsen.
In Bezug auf die Regulierung seiner Aktivität besteht ein Merkmal, das zwischen den Enzymen der Gruppe der α-Amylasen geteilt wird.
Struktur
Α-Amylase ist ein Multidominiumenzym, das bei Tieren und Pflanzen ein ungefähres Molekulargewicht von 50 kDa hat und verschiedene Autoren einverstanden sind.
Die zentrale Domäne oder die katalytische Domäne ist sehr erhalten und ist als Domäne A bekannt, die aus einer symmetrischen Falte von 8 β-platten Blättern besteht, die in Form eines „Fass“ angeordnet sind, das von 8 Alpha-Hallen umgeben ist, sodass Sie auch finden können In der Literatur, wie (β/α) 8 oder "Tim" Fass treiben.
Es ist wichtig zu beachten das Protein.
Es kann Ihnen dienen: Fauna und Flora des peruanischen MeeresEin weiteres der am häufigsten untersuchten Domänen dieser Enzyme ist das sogenannte Ding B, das zwischen der β-Peeled-Lamina und dem Alpha-Nummer-3-Propeller der Domäne A auffällt. Dies spielt eine grundlegende Rolle in der Vereinigung des Substrats und des trennen Kalziums.
Zusätzliche Domänen wurden für α-Amylas-Enzyme wie Domänen C, D, F, G, H und I beschrieben, die sich vor oder hinten der Domäne A befinden und deren Funktionen nicht genau bekannt sind und von dem Organismus abhängen, der davon abhängt, dass es wird untersucht.
α-Amylasen von Mikroorganismen
Das Molekulargewicht von α-Amylasen hängt ebenso wie andere biochemische und strukturelle Eigenschaften von dem untersuchten Organismus ab. Somit haben die α-Amylasen vieler Pilze und Bakterien Gewichte von nur 10 kDa und bis zu 210 kDa.
Das hohe Molekulargewicht einiger dieser mikrobiellen Enzyme hängt häufig mit dem Vorhandensein von Glykosilation zusammen, obwohl die Glykosylierung von Protein in Bakterien sehr selten ist.
Funktionen
Bei Tieren sind α-Amylasen für die ersten Schritte im Stoffwechsel von Stärke und Glykogen verantwortlich, da sie für ihre Hydrolyse zu kleineren Fragmenten verantwortlich sind. Die Organe des Magen -Darm -Systems, das für ihre Produktion bei Säugetieren zuständig ist, sind die Bauchspeicheldrüse und die Speicheldrüsen.
Zusätzlich zu seiner offensichtlichen Stoffwechselfunktion wird die Produktion von α-Amylasen, die durch die durch Noradrenalinwirkung aktivierten Speicheldrüsen vieler Säugetierungen erzeugt werden.
Es hat auch sekundäre Funktionen in der Mundgesundheit, da seine Aktivität bei der Eliminierung oraler Bakterien und bei der Vorbeugung seiner Haftung an oralen Oberflächen arbeitet.
Es kann Ihnen dienen: sympatrische Speziation: Konzept, Merkmale und BeispieleHauptfunktion in Pflanzen
In Pflanzen spielen α-Amylasen eine primäre Rolle bei der Keimung von Samen, da sie die Enzyme sind, die die in dem Endosperm vorhandene Stärke hydrolysieren.
Industrielle Anwendungen
Enzyme, die zur Familie von α-Amylasen gehören, haben in vielen verschiedenen Kontexten mehrere Anwendungen: industriell, wissenschaftlich und biotechnologisch usw.
In großen Stärkeverarbeitungsindustrien werden α-Amylasen im Volksmund für die Glukose- und Fructoseproduktion sowie für die Produktion von Brot mit verbesserten Texturen und mit größerer loyaler Kapazität eingesetzt.
Im biotechnologischen Bereich besteht ein großes Interesse an der Verbesserung der kommerziell verwendeten Enzyme, um ihre Stabilität und Leistung unter verschiedenen Bedingungen zu verbessern.
Verweise
- Aiyer, p. V. (2005). Amylasen und ihre Anwendungen. Afrikanischer Journal of Biotechnology, 4(13), 1525-1529.
- Bernfeld, p. (1960). Amylasen, a und b. In Enzyme des Kohlenhydratstoffwechsels (Vol. Ich, pp. 149-158).
- Granger, d. ZU., Kivighan, k. T., Ihnen., Gordis, e. B., & Stud, l. R. (2007). Speichel-A-Andlase in der Biobehavioralforschung. Jüngste Entwicklungen und Anwendungen. Ann. N.UND. Acade. Sci., 1098, 122-144.
- Monteiro, p., & Oliveira, p. (2010). Anwendung der mikrobiellen A-Andslase in der Industrie- ein Überblick. Brasilianisches Journal of Microbiology, 41, 850-861.
- Reddy, n. S., Nimmagadda, a., & Rao, k. R. S. S. (2003). Ein Überblick über die mikrobielle α-Love-Familie. Afrikanischer Journal of Biotechnology, 2(12), 645-648.
- Salz, w., & Shenker, s. (1976). Amylase- seine klinische Bedeutung: Eine Überprüfung der Literatur. Medizin, 55(4), 269-289.
- Svensson, geb., & MacGregor und. ZU. (2001). Beziehung von Sequenz und Struktur zur Spezifität in der A-Amylase-Familie von Enzymen. Biochimica et Biophysica Acta, 1546, 1-20.
- Thoma, j. ZU., Spradlin, J. UND., & Dygert, s. (1925). Pflanzen- und Tieramylasen. Ann. Chem., 1, 115-189.
- « Reninstruktur, Produktion, Sekretion, Funktionen
- Urie Bronfenbrenner -Biographie, ökologisches Modell und Beiträge »

