Aloosterismus Allgemeine Aspekte, Funktionen und Beispiele

- 4916
- 1415
- Ibrahim Steuk
Er Alosterismus o Alostrische Regulation ist definiert als der Prozess der Hemmung oder Aktivierung eines durch ein regulatorischen Moleküls vermittelten Enzyms.
Der Begriff "alosterisch" oder "Alosterismus" stammt aus den griechischen Wurzeln "Allosen ", was bedeutet "ein anderer" und "Stereós", was "Form" oder "Ort" bedeutet; So übersetzt es sich also buchstäblich als "anderer Raum", "ein anderer Ort" oder "eine andere Struktur".
 Grafikschema von A zu Theosteric Regulation. (A) aktiver Zentrum. (B) Alosteric Site. (C) Substrat. (D) Inhibitor. (E) Enzym. (Quelle: ISAAC Webb [CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons)
Grafikschema von A zu Theosteric Regulation. (A) aktiver Zentrum. (B) Alosteric Site. (C) Substrat. (D) Inhibitor. (E) Enzym. (Quelle: ISAAC Webb [CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons) Einige Autoren beschreiben Aloosterismus als einen Prozess, durch den entfernte Stellen in einem System (z. im gleichen.
Diese Art der Regulierung ist typisch für die Enzyme, die an mehreren bekannten biologischen Prozessen wie Signaltransduktion, Metabolismus (Anabolismus und Katabolismus), der Regulation der genetischen Expression, beteiligt sind.
Die ersten Ideen zum Alosterismus und ihre Teilnahme an der Kontrolle des Zellstoffwechsels wurden in den 1960er Jahren von F postuliert. Monod, f. Jacob und J. Changeeux untersuchte während der Untersuchung der Biosynthesewege verschiedene Aminosäuren, die nach der Ansammlung der Endprodukte inhibiert wurden.
Obwohl die erste Veröffentlichung in dieser Hinsicht mit genetischer Regulierung zu tun hatte, erweiterte kurze Zeit später Monod, Wyman und Changeeux die Konzeption von Aloosterismus auf Proteine mit enzymatischer Aktivität und schlugen ein Modell vor, das auf multimeren Proteinen basiert, das haupt von diesen schloss sich einem Effektor an.
Kann Ihnen dienen: Guanina: Eigenschaften, Struktur, Training und FunktionenViele der nachfolgenden Konzepte hatten ihre Grundlage in der Theorie der "induzierten Anpassung", die einige Jahre zuvor von Koshland eingeführt wurde.
[TOC]
Allgemeine Merkmale
Im Allgemeinen haben alle Enzyme zwei verschiedene Stellen für die Ligandenvereinigung: Eines ist als aktives Zentrum bekannt, das sich den Molekülen verbindet, die als Substrat fungieren (verantwortlich für die biologische Aktivität des Enzyms), und der andere ist der andere als Theosteric bekannt als Theosteric Site, die spezifisch für andere Metaboliten ist.
Diese "anderen Metaboliten" werden als alestherische Effektoren bezeichnet und können positive oder negative Auswirkungen auf die Geschwindigkeit der Reaktionen haben, die durch Enzyme katalysiert werden.
Normalerweise wirkt sich die Vereinigung eines Effektors auf das AL, eine Enzymstelle.
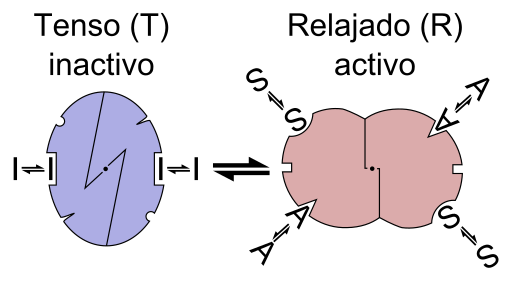 Grafikschema der Reaktion eines Enzyms Alosterica (Quelle: Datei: Enzym -Allosterie ist.PNG: Datei: Enzym -Allosterie.PNG: Allostery.PNG: Nicolas le Novere (Talk).Lenov bei in.Wikipediaderivative Arbeit: Timvickers (Diskussion) Derivat.Org/lizenzen/by-sa/3.0) über Wikimedia Commons)
Grafikschema der Reaktion eines Enzyms Alosterica (Quelle: Datei: Enzym -Allosterie ist.PNG: Datei: Enzym -Allosterie.PNG: Allostery.PNG: Nicolas le Novere (Talk).Lenov bei in.Wikipediaderivative Arbeit: Timvickers (Diskussion) Derivat.Org/lizenzen/by-sa/3.0) über Wikimedia Commons) Mit anderen Worten, die Vereinigung eines Alestro -Effektors an seinen spezifischen Ort in der Struktur eines Enzyms führt zu einer Änderung der molekularen Geometrie des Enzym Während des gesamten Makromoleküls, modifiziert sein Verhalten.
Alosterismus kann homotrop oder heterotrop sein. Ein homotropes alostroischer Regulationsprozess ist definiert als derjenige, bei dem das gleiche Substrat eines Enzyms als sein alestischer Regulator wirkt, dh der alosterische Effektor ist das gleiche Substrat; Es ist auch als eine Art Genossenschaft bekannt.
Ein heterotropen Regulationsprozess bezieht sich andererseits auf die Regulation der Aktivität eines durch ein Moleküls oder Effektors der Theosteric vermittelten Enzym.
Es kann Ihnen dienen: aptenia cordfolia: Eigenschaften, Lebensraum, Eigenschaften, KultivierungFunktionen
Aloosterismus ist zusammen mit der Regulation der genetischen Expression, der Translation und des Proteinabbaus einer der grundlegenden Mechanismen für die Regulation einer großen Anzahl organischer Prozesse, was für die Aufrechterhaltung der Homöostase und zum Überleben von allen lebenden, einheitlichen oder multizellulären Mechanismen wesentlich ist Wesen.
Die toostale Regulierung oder Aloosterismus gibt lebende Organismen die Fähigkeit, mit großer Empfindlichkeit gegenüber Veränderungen der Konzentration von regulatorischen Liganden sowie den Ursprungs -rhythmischen Phänomenen auf zellulärer Ebene zu reagieren.
Da Energie- und metabolische Substrate in einer Zelle endlich sind, ermöglicht Alosterismus im Stoffwechselfeld die mäßige Verwendung von Ressourcen, vermeidet sowohl nutzlose Zyklen.
In ähnlicher Weise ist dieser Regulationsmechanismus für Zellsignalprozesse von großer Bedeutung, bei denen viele Konformationsänderungen, die durch die Vereinigung verschiedener Liganden an bestimmten Stellen der fraglichen Rezeptoren ausgelöst werden, ausgelöst werden.
Beispiele für Aloosterismus
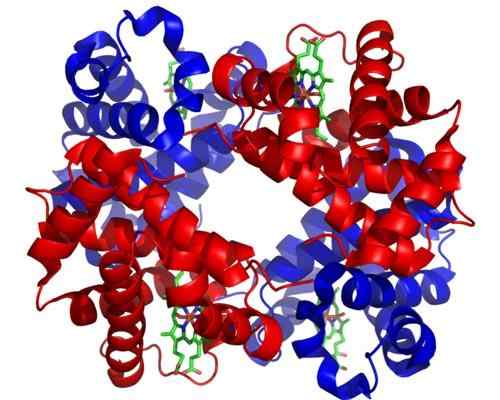 Hämoglobin. Genommen und bearbeitet von: Zephyris in der englischen Sprache Wikipedia [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]].
Hämoglobin. Genommen und bearbeitet von: Zephyris in der englischen Sprache Wikipedia [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]. Obwohl es Tausende von Beispielen für den Toosterismus oder die Regulierung in der Natur gibt, waren einige stärker ausgeprägt als andere. Dies ist der Fall von Hämoglobin, das eines der ersten Proteine war.
Hämoglobin ist für viele Tiere ein sehr wichtiges Protein, da es für den Transport von Sauerstoff durch das Blut von der Lunge zu den Geweben verantwortlich ist. Dieses Protein präsentiert gleichzeitig homotrope und heterotrope der Theosteric -Regulation.
Kann Ihnen dienen: Saltakionismus: Merkmale, Beweise und BeispieleDer homotrope Aloosterismus von Hämoglobin hat mit der Vereinigung eines Sauerstoffmoleküls zu einer der Untereinheiten zu tun, die es zusammensetzen, die sich direkt auf die Affinität auswirkt, mit.
Heterotrop zum heterotropen
Heterotropen Alosterismus hängt andererseits mit den Auswirkungen des pH-Werts als auch mit dem Vorhandensein von 2,3-Diffoglyceration auf die Vereinigung von Sauerstoff zu den Untereinheiten dieses Enzyms zusammen und hemmt ihn.
Transcarbamilase oder ATCASA -Aspartat, das an der Pyrimidin -Syntheseroute teilnimmt, ist auch eines der „klassischen“ Beispiele für alosterische Regulierung. Dieses Enzym mit 12 Untereinheiten, von denen 6 katalytisch aktiv und 6 Regulatoren sind, wird heterotrop durch das Endprodukt der Strecke, die Köpfe, das Cytidinininatrifosphat (CTP), hemmt.
Lactose Operon UND. coli
Die Frucht der ersten Ideen von Monod, Jacob und Changeaux war ein von Jacob und Monod veröffentlichter Artikel im Zusammenhang mit der Laktose der Laktose der Laktose von Escherichia coliYo, Dies ist eine der typischen Beispiele für heterotrope bis genetische Regulierungsregulierung.
Die toostale Regulation dieses Systems hängt nicht mit der Fähigkeit zusammen, ein Substrat in ein Produkt umzuwandeln, sondern mit der Affinität der Vereinigung eines Proteins in die operative DNA -Region.
Verweise
- Changeeux, J. P., & Edelstein, s. J. (2005). Allosterische Mechanismen der Signaltransduktion. Science, 308 (5727), 1424-1428.
- Goldbeter, a., & Dupont, g. (1990). Allosterische Regulierung, Kooperität und biochemische Schwingungen. Biophysikalische Chemie, 37 (1-3), 341-353.
- Jiao, w., & Parker und. J. (2012). Unter Verwendung einer Kompination von Rechen- und Versuchstechniken, um die molekulare Grundlage für die Proteinalosterie zu verstehen. In Fortschritten in der Proteinchemie und -strukturbiologie (vol. 87, pp. 391-413). Akademische Presse.
- Kern, d., & Zuiderweg und. R. (2003). Die Rolle der Dynamik in der allosterischen Regulierung. Aktuelle Meinung in der Strukturbiologie, 13 (6), 748-757.
- Laskowski, r. ZU., Gerick, f., & Thornton, J. M. (2009). Die strukturelle Grundlage der allosterischen Regulierung in Proteinen. FEBS Letters, 583 (11), 1692-1698.
- Mathews, c. K., Van Holde, K. UND., & Ahern, k. G. (2000). Biochemie, hrsg. San Francisco, Kalifornien.
- « Kohlenstoffnanoröhrenstruktur, Eigenschaften, Anwendungen, Toxizität
- Adaptiver Strahlungsprozess, Typen und Beispiele »

