Alkene
- 2522
- 720
- Ivan Pressler
 Alkene oder Olefine sind ungesättigte Kohlenwasserstoffe, die mindestens eine Doppelkohlenstoffbindung in ihrer Struktur haben
Alkene oder Olefine sind ungesättigte Kohlenwasserstoffe, die mindestens eine Doppelkohlenstoffbindung in ihrer Struktur haben Was sind Alkene??
Der Alkene oder Olefine Sie sind ungesättigte Kohlenwasserstoffe, die mindestens eine Doppelbindung in ihrer Struktur haben. Sie werden als Olefine bezeichnet. Derzeit wurde der Begriff Olefinas stillgelegt und diese Verbindungen werden nun Alkene genannt.
Die physikalischen Eigenschaften von Alkenen werden durch ihr Molekulargewicht sowie ihr kohlensäurehaltiges Skelett beeinflusst. Zum Beispiel sind Alkene mit 2 bis 4 Kohlenstoffen (Buten E -Etene) Gase. Mit 5 bis 18 Kohlenstoffatomen in der Langkette sind flüssig. Während Alkene mit mehr als 18 Kohlenstoffatomen fest sind.
Das Vorhandensein einer Doppelbindung liefert große Reaktivität und erfährt so viele chemische Reaktionen wie Addition, Eliminierung, Hydratation und Polymerisation, die es ihm ermöglichen, zahlreiche Verwendungen und Anwendungen zu erzeugen.
Alkene werden industriell durch das thermische Knacken von hohem Molekulargewicht (Paraffinwachs) produziert; Katalytischer Dehydrierung und Chlorination-Dehydroclination.
Chemische Struktur von Alkenen
 Quelle: Selbst gemacht
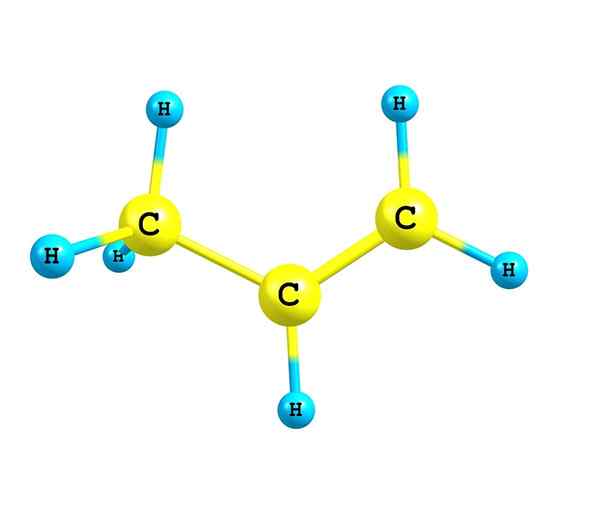
Quelle: Selbst gemacht Alkene sind durch eine oder mehrere Doppelverbindungen in ihrer Struktur gekennzeichnet. Dies wird als c = c dargestellt, da beide Kohlenstoffatome eine SP -Hybridisierung haben2.
Daher ist die Kettenregion, in der Doppelbindung oder Unsättigung ist, flach. Es ist auch Verdienst, darauf hinzuweisen, dass die beiden Kohlenstoffe mit zwei anderen Substituenten (oder Gruppen) verbunden werden können.
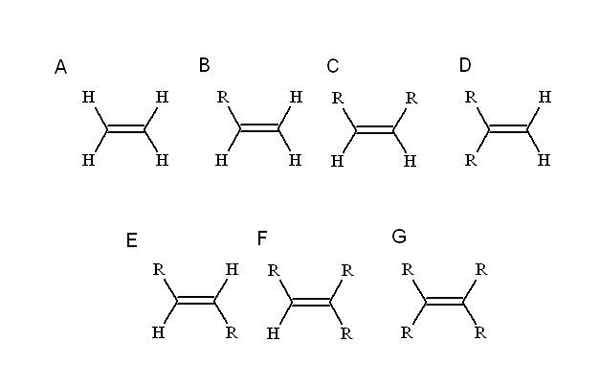
Welche Substituenten? Jeder, der eines der einfachsten Alken -Hydrogene ersetzt: Ethylen (oder Eteno). Ausgehend von ihm (a, überlegenes Bild) r, einem alquilischen Substituenten, nimmt den Ort eines der vier Wasserstoffe ein, um einen Mono-Untersteuerteilungs-Alken zu verursachen (b).
Bisher ist die Identität von B nicht verändert, unabhängig davon, welcher Wasserstoff ersetzt wird. Dies bedeutet, dass es keine Stereoisomere gibt, die aus gleichen chemischen Formeln, jedoch mit einer anderen räumlichen Disposition seiner Atome bestehen.
Kann Ihnen dienen: ÄquivalenzpunktStereoisomere
Wenn ein zweiter Wasserstoff durch ein anderes r ersetzt wird, wie in C, jetzt die Stereoisomere C, D und E. Dies liegt daran, dass räumliche Orientierungen in Bezug auf beide R variieren und sich gegenseitig erkennen, cis-trans oder e-z-Zuordnungen verwendet werden.
In C, Di-Substitut-Alken, können die beiden R Ketten jeglicher Länge oder eines Heteroátomo sein. Einer befindet sich in der frontalen Position in Bezug auf den anderen. Wenn die beiden R aus demselben Substituenten, F, zum Beispiel bestehen, ist C die Stereoisomer-CIS.
In D sind beide R -Gruppen noch näher, da sie mit demselben Kohlenstoffatom verbunden sind. Dies ist die Geminal -Stereoisomer, obwohl es mehr als ein Stereoisomer ist, es ist tatsächlich eine terminale Doppelbindung, dh, dass es sich am Ende oder Prinzip einer Kette befindet (aus diesem Grund hat es zwei Hydrogenen, den anderen Kohlenstoff).
Und in e, den stabilsten Stereoisomeren (oder geometrischen Isomeren), werden die beiden R -Gruppen durch einen größeren Abstand getrennt, der die Diagonale der Doppelbindung überschreitet. Warum ist das stabilste? Es ist, weil die räumliche Trennung zwischen ihnen größer ist, so dass es keine Schwesterspannung zwischen den beiden gibt.
Auf der anderen Seite sind F und G Tri- und Tetra-wiedererlangte Alkene. Auch hier können sie keine Stereoisomer erzeugen.
Physikalische und chemische Eigenschaften von Alkenen
Löslichkeit
Sie sind aufgrund ihrer geringen Polarität mit Wasser nicht mischbar. Aber sie lösen sich in organischen Lösungsmitteln auf.
Fusionspunkte bei ºC
Etano -169, Propeno -185, 1 -Pentine -165, 1 -hepteno -119, 3 -octein
-101,9, 3 -none -81,4 und 5 -detechnik -66,3.
Siedepunkt in º c
Etano -104, propeno -47, trans2buteno 0,9, cis2buteno 3,7, 1-pensen 30, 1-hepteno 115, 3-ac 122, 3-Noneno 147 und 5-Dekend.
Kann Ihnen dienen: Laborfilter): Merkmale, Funktionen, TypenDer Siedepunkt nimmt in direktem Zusammenhang mit der Anzahl der Alken -Kohlenhydrate zu. Auf der anderen Seite sind die schwächsten wechselwirkungen, je mehr seine Struktur verzweigt, die sich in der Abnahme des Sieiles oder des Fusionspunkts widerspiegelt.
Dichte
Etano 0,6128 mg/ml, Propeno 0,6142 mg/ml und 1-Butene 0,6356 mg/ml, 1-Pente 0,64 mg/ml und 1-Hexen 0,673.
In Alkenen beträgt die maximale Dichte 0,80 mg/ml. Das heißt, sie sind weniger dicht als Wasser.
Polarität
Es hängt von der chemischen Struktur, Substitutionen und dem Vorhandensein anderer funktioneller Gruppen ab. Die Alkene haben einen Dipmer, also das 2-Buten-CIS-Isomer.
Alkene Reaktivität
Alkene haben aufgrund der doppelten Verbindungen, die sie haben. Unter den beteiligten Reaktionen sind: Addition, Eliminierung, Ersatz, Hydrierung, Hydratation und Polymerisation.
Additionsreaktion
H2C = Ch2 + Cl2 => Clch2-Cclh2 (Ethylen -Dichlorid)
Hydrierungsreaktion
Es tritt bei hohen Temperaturen und in Gegenwart angemessener Katalysatoren auf (PT, PD oder fein geteilt)
CH2= Ch2 + H2 => Ch3-CH3 (Etano)
Hydratationsreaktion
Reaktion, die die Quelle der Alkoholerzeugung aus Ölderivaten ist:
H2C = Ch2 + H2O => h3C-ch2Oh (Ethylalkohol)
Polymerisationsreaktionen
Ethylen in Gegenwart von Katalysatoren wie Aluminium -Versuch und Titantetrachloridpolymeriza in Polyethylen, die etwa 800 Kohlenstoffatome enthält. Diese Art von Polymer wird als Additionspolymer bezeichnet.
Verwendung und Anwendungen von Alkenen
Polymere
- Polyethylen mit geringer Dichte wird zur Herstellung von Taschen, Gewächshauskunststoffen, Verpackungen, Gerichten, Gefäßen usw. verwendet. Während die hohe Dichte starrer und mechanisch resistenter ist und bei der Herstellung von Kisten, Möbeln, Beschützern wie Helmen und Knien, Spielzeug und Paletten verwendet wird.
- Polypropylen, Propylenpolymer, wird zur Ausarbeitung von Behältern, Blättern, Laborgeräten, Spielzeug, Verpackungsfilmen, Sogas -Filamenten, Polster und Teppichen verwendet.
- Polyvinylchlorid (PVC) ist ein Polymer aus Vinylchlorid, das zur Herstellung von Röhrchen, Fliesen für Böden, Kanäle, Türen und Fensterrahmen usw. verwendet wird.
- Polybutadien, Polymer von 1,3-Butadien, ist für die Herstellung von Lagerbändern, Schläuchen und Fahrzeuggurten sowie für die Beschichtung metallischer Dosen bestimmt.
- Ethylen- und Propylencopolymere werden zur Herstellung von Schläuchen, Körper und Teilen des Gehäuses für Textilien usw. verwendet.
Alkene
- Sie werden verwendet, um Lösungsmittel wie Ethylenglykol und Dioxan zu erhalten. Ethylenglykol wird als Frostschutzmittel in Autokühler verwendet.
- Ethylen ist ein Hormon von Pflanzen, das sein Wachstum, seine Samenkeimung und die Entwicklung von Früchten kontrolliert. Daher wird es verwendet, um die Reifung von Bananen zu induzieren, wenn sie ihr Ziel erreichen.
- Sie werden als Rohstoff für die Herstellung vieler Verbindungen wie Alkylhalogeniden, Ethylenoxid und insbesondere Ethanol verwendet. Sie werden auch in Industrie, Körperpflege und Medizin verwendet.
- Sie werden zum Erhalten und Herstellen von Lackern, Reinigungsmitteln, Aldehyden und Brennstoffen verwendet. 1.3-Butadieno wird als Rohstoff bei der Herstellung von synthetischen Gummi verwendet.
Verweise
- Chemiezuordnung. Physikalische Eigenschaften von Alkenen. Entnommen aus: Chemie-Anweisung.com
- Wikipedia. (2018). Alken. Genommen von: in: in.Wikipedia.Org
- Chemistry Librettexts. Physikalische Eigenschaften von Alkenen. Genommen von: Chem.Librettexts.Org
- Whitten, Davis, Peck & Stanley. Chemie. (8. Aufl.). Cengage Lernen.
- Francis a. Schildpatt. Organische Chemie. (Sechste Ausgabe., Seite 194). Mc Graw Hill.
- Houchton Mifflin Harcourt. (2016). Alkene: molekulare und strukturelle Formeln. Entnommen aus: Cliffsnotes.com
- Chiantera, Angie. (25. April 2017). Was ist ein Olefin in der Chemie? Wissenschaftlich. Entnommen aus: Wissenschaft.com

