Anafilotoxin -Typen, Funktionen und Empfänger
- 2539
- 547
- Frederike Birkemeyer
Der Anafilotoxine Sie sind Peptidfragmente mit niedrigem Molekulargewicht, die durch die Aktivierung des Komplementsystems erzeugt werden. Sie sind sehr hydrophil, mit einer Struktur in der Alpha -Halle, die durch 3 Disulfidbrücken verbunden ist.
Sie werden proteolytisch durch Bruch an einer bestimmten Stelle aktiviert und bilden Fragmente A und B. Diese Peptide binden an spezifische Rezeptoren, die auf der Oberfläche der Zellen exprimiert werden.
 Protein vom Typ C5A Anaphylotoxin. Von Jawahar Swaminathan und MSD -Mitarbeitern des Europäischen Bioinformatikinstituts [Public Domain (https: // CreativeCommons.org/lizenzen)] aus Wikimedia Commons.
Protein vom Typ C5A Anaphylotoxin. Von Jawahar Swaminathan und MSD -Mitarbeitern des Europäischen Bioinformatikinstituts [Public Domain (https: // CreativeCommons.org/lizenzen)] aus Wikimedia Commons. Seine Effektorfunktionen umfassen Chemotoxis, Freisetzung von Entzündungsmediatoren und Granulozyten, Mastzellen und Makrophagen. Vor kurzem wurde auch gezeigt, dass Anaphylotoxine durch das Vorhandensein von Krankheitserregern lokal im Gewebe erzeugt werden.
[TOC]
Leute
Anafilotoxine umfassen C3A-, C5A- und C4A -Peptide. Dies sind Fragmente von niedrigem molekularem Massenspalten (~ 10 kDa) der α -Kette der Komponenten des Komplements C3, C4 und C5, die während der Komplementaktivierung freigesetzt werden.
Es ist jedoch zu beachten, dass für C4A nur gezeigt wurde.
C5A für seinen Teil ist der mächtigste dieser Peptide, das heißt Entzündung und ein attraktives Chimio für Neutrophile, Makrophagen und Monozyten.
Obwohl niedrigere Wirbeltiere Komplementsysteme haben, von denen angenommen wird.
Funktionen
Anafilotoxine werden aus dem enzymatischen Split während des Komplementaktivierungsverlaufs über klassische, Lektin oder alternative Straßen erzeugt.
Es kann Ihnen dienen: Flora und Fauna aus ItalienIm Wasserfall der Komplementaktivierung führt die Spaltung von C3 oder C5 für den umgewandelten C3 oder C5 zur Erzeugung eines großen Fragments C3B oder C5B und eines kleinen Fragments aus Peptid, C3A oder C5A.
C3B und C5B setzen den Wasserfall der Komplementaktivierung auf mikrobielle oder zelluläre Oberflächen fort.
Sie erhöhen die Gefäßpermeabilität, stimulieren die Kontraktionen der glatten Muskeln und induzieren die Befreiung von Histamin aus Mastzellen und den sekretorischen Granulaten der Granulozyten und Makrophagen.
Darüber hinaus ist C5A, einer der mächtigsten Peptide, ein starker Chemoatraente für Neutrophile und andere Leukozyten.
Es wurden keine chemioatrayenten Eigenschaften auf C4A zurückgeführt, während die von C3A hauptsächlich Eosinophilen, Mastzellen und hämopoetischen Stammzellen der Kontraktion des glatten Muskels, einer erhöhten Permeabilität von Blutkapillaren und sogar anaphylaktischer Schock zu sein scheinen.
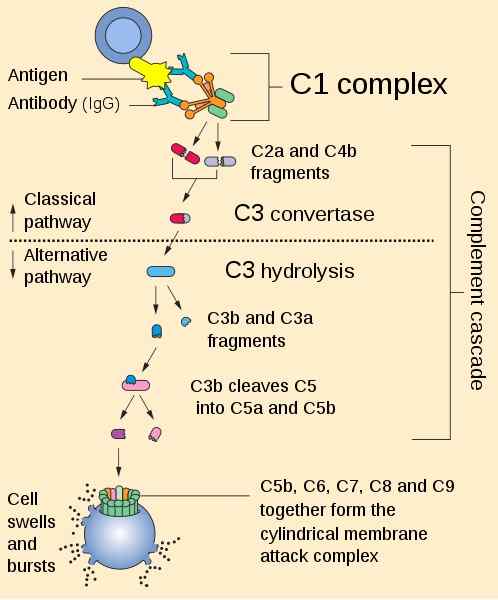
Zusammenfassung der Komplement -Wasserfallaktivierungsroute. Von Perhelion [Public Domain (https: // CreateRecommons.org/lizenzen)] aus Wikimedia Commons.
.
Assoziation von C5A und C3A mit Pathogenese
Obwohl C5A- und C3A -Entzündung eine wichtige Rolle bei der Kontrolle der Infektion spielt, hat eine Reihe klinischer Studien gezeigt, dass sie auch mit der Pathogenese mehrerer entzündlicher und Autoimmunerkrankungen wie Sepsis, dem systemischen Lupus erythematosus (LES), assoziiert sind der Schwangerschaft, Antiphospholipid -Antikörper -Syndrom (SAFL), Ischämie und Asthma.
Auf diese Weise wurde vermutet, dass das Angriff auf die Rezeptoren und/oder Liganden von C5A und C3A unerwünschte entzündliche Reaktionen sowie Gewebeschäden an bestimmten pathologischen Bedingungen verringern könnte. C5A und C3A können therapeutisch weiße effizient sein.
Kann Ihnen dienen: ABO -System: Inkompatibilität, Erbschaft und BeweisRezeptoren
Im Allgemeinen üben Anafilotoxine die meisten biologischen Aktivitäten durch die Vereinigung von drei verwandten Rezeptoren aus, dh; Der C3A -Empfänger, der C5A -Empfänger und der C5A -Empfänger C5L2.
Beim Menschen wurden drei Arten von Transmembranrezeptoren identifiziert, die die Wirkungen von Anaphylotoxinen vermitteln: den C3AR, der spezifisch C3A verbindet; der C5AR, der an C5A bindet; und der C5L2, für den die drei Anafilotoxine Liganden sein können.
Die ersten beiden Rezeptoren sind an regulatorische G -Proteine gekoppelt, während der C5L2 -Empfänger gezeigt wurde.
Die Verteilung dieser Rezeptoren ist nicht auf Leukozyten beschränkt. Sie werden auch in vielen Arten von Nicht -Myloidzellen exprimiert, einschließlich Hepatozyten, pulmonaler Epithelzellen, Endothelzellen, Gehirnastrozyten und Mikrogliazellen.
In diesen Zellentypen können sie die Beteiligung von Anafilotoxinen unter mehreren vaskulären, pulmonalen, regenerativen und degenerativen neurologischen Erkrankungen vermitteln.
Wenn Anaphylotoxine nicht an ihre Rezeptoren binden, werden diese schnell durch Plasma-Carboxypen verdaut, die den C-terminalen Argininrest jedes Peptids eliminieren.
Argininderivate sind inaktiv oder haben Aktivitäten 10- bis 1000 -mal niedriger als die von nativen Peptiden.
Komplementsysteme in niedrigeren Wirbeltieren
Die unteren Wirbeltiere wie Reptilien, Amphibien und Fische haben Komplementsysteme, die in vielerlei Hinsicht als funktionell ähnlich denen von Säugetieren angesehen werden.
Bei einigen dieser Tiere wurden durch Komplemente wie Zytolyse und Opsonisierung schützende Immunantworten nachgewiesen.
Kann Ihnen dienen: Was ist Leptoten?Vor kurzem wurde gezeigt, dass der Tunicado C3A Ciona intestinalis Es verfügt über chemotaktische Aktivitäten für intestete Hämozyten, was auf das Vorhandensein eines C3AR -Rezeptors bei diesen Tieren hindeutet.
Diese Protokordente besitzen möglicherweise nicht C4A und C5A. Daher wird angenommen.
Gnatostome haben jedoch alle bekannten Komplementaktivierungsrouten, und die C3-, C4- und C5 -Moleküle mehrerer Fischarten wurden identifiziert. Interessanterweise haben Fische mehrere Isoformen mehrerer der Komplementkomponenten, einschließlich C3, C2 / BF, C4 und C5.
Obwohl für C3 -Isoformen unterschiedliche Funktionen vorgeschlagen wurden, bleibt abzuwarten, ob es für diese Isoformen unterschiedliche Rezeptoren gibt.
Verweise
- Von Yang. Anapophylatoxens. Handbuch mit biologischen aktiven Peptiden.pp.625-630 http: // dx.doi.org/10.1016/B978-0-12-385095-9.00085-3
- Gennaro R, Simonic T, Negri A, Mottola C, Secchi C, Ronchi S, Romeo D. C5A -Fragment der Ergänzung von Rinder. Reinigung, Bioassays, Aminino-Säure-Sequenz und andere strukturelle Studien. Europäisches Journal of Biochemistry. 1986; 155 (1): 77-86.
- Holland CH, Lambris JD. Funktioneller C5A -Anaphylatoxin -Empfänger in einer Teleost -Spezies. Das Journal of Immunology. 2004; 172 (1): 349-355.
- KLOS A., Tenner AJ, Johswich K, Ager R, Reis Es, Köhlc J. J. Die Rolle der Anapophylatoxionen bei Gesundheit und Krankheit. Molekulare Immunologie. 2009; 46 (14): 2753-2766.
- Ogata RT, Rosa PA, ZEPF NE. Sequenz des Gens für die Komplementkomponente von Maus C4. Das Journal of Biological Chemistry. 1989, 264 (28): 16565-16572.
- Peng Q, Li K, Säcke SH, Zhou W. Die Rolle von Anaphylatoxons C3A und C5A bei der Regulierung der angeborenen und adaptiven Immunantwort. Entzündungs- und Allergie -Arzneimittelziele. 2009; 8 (3): 236-246.
- « Nebenkommunikationsmerkmale, Vorteile, Nachteile, Beispiele
- Tour -Diagramm Wofür ist es, wie wird es getan, Beispiele? »

