Anhydride

- 3776
- 318
- Timo Rabenstein
Was sind Anhydride?
Der Anhydride Sie sind chemische Verbindungen, die aus der Vereinigung von zwei Molekülen durch Befreiung von Wasser stammen. Somit könnte es als Dehydration der anfänglichen Substanzen angesehen werden; Obwohl es nicht genau wahr ist.
In der organischen und anorganischen Chemie werden sie erwähnt, und in beiden Zweigen unterscheidet sich ihr Verständnis in einem merklichen Ausmaß. Zum Beispiel werden in der anorganischen Chemie als Basis- und Säuroxide wie Anhydrien ihrer Hydroxide bzw. Säuren angesehen, da er erstere mit Wasser reagiert, um die zweite zu bilden.
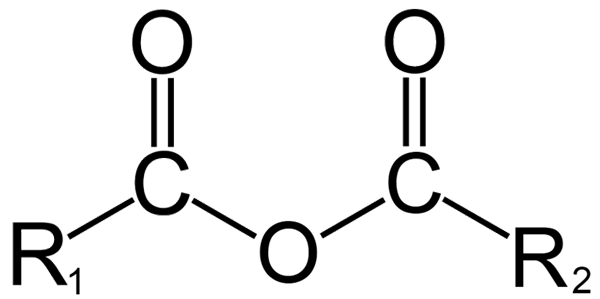 Allgemeine Struktur von Anhydriden. Quelle: Dremmetbrownie [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] aus Wikimedia Commons
Allgemeine Struktur von Anhydriden. Quelle: Dremmetbrownie [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] aus Wikimedia Commons Hier kann eine Verwirrung zwischen den Begriffen "wasserfrei" und "Anhydrido" erzeugt werden. Im Allgemeinen bezieht sich wasserfrei auf eine Verbindung, zu der sie ohne Veränderungen in ihrer chemischen Natur dehydriert wurde (es gibt keine Reaktion); Während mit einem Anhydrid gibt es eine chemische Veränderung, die sich in der molekularen Struktur widerspiegelt.
Wenn die entsprechenden Hydroxide und Säuren (oder Anhydride) verglichen werden, wird beobachtet, dass es eine Reaktion gab. Andererseits können einige Oxide oder Salze hydratisiert sein, Wasser verlieren und weiterhin die gleichen Verbindungen haben. Aber ohne Wasser, das heißt Anhydros.
In der organischen Chemie hingegen ist das, was durch Anhydrid versteht, die anfängliche Definition. Zum Beispiel sind einer der bekanntesten Anhydride diejenigen, die von Carboxylsäuren abgeleitet wurden (überlegenes Bild). Diese bestehen aus der Vereinigung von zwei Acylgruppen (-rco) durch ein Sauerstoffatom.
In seiner allgemeinen Struktur ist R angezeigt1 Für eine Acylgruppe und r2 Für die zweite Acilo -Gruppe. Weil r1 und r2 Sie unterscheiden. Wenn beide Substituenten R (ob aromatisch) gleich sind, wird in diesem Fall ein Symmetrisäureanhydrid gesprochen.
Zum Zeitpunkt der Verknüpfung von zwei Carboxsäuren zur Bildung von Anhydrid kann sich Wasser sowie andere Verbindungen bilden oder nicht. Alles hängt von der Struktur dieser Säuren ab.
Anhydride Eigenschaften
Die Eigenschaften von Anhydriden hängen davon ab, auf welche bezieht. Fast jeder hat gemeinsam, dass sie mit Wasser reagieren. Für die sogenannten grundlegenden Anhydride in anorganischen sind einige von ihnen jedoch sogar unlöslich in Wasser (MGO).
Fusions- und Siedepunkte fallen auf die molekulare Struktur und intermolekulare Wechselwirkungen für (RCO)2Oder dies ist die allgemeine chemische Formel dieser organischen Verbindungen.
Wenn die molekulare Masse von (RCO)2Oder es ist niedrig, es ist wahrscheinlich eine farblose Flüssigkeit bei Raumtemperatur und Druck. Zum Beispiel Essigsäureanhydrid (oder Ehydridge3CO)2Oder es ist eine flüssige und wichtigste industrielle Bedeutung, seine Produktion ist sehr groß.
Die Reaktion zwischen Essigsäureanhydrid und Wasser wird durch die folgende chemische Gleichung dargestellt:
(CH3CO)2Oder + h2O => 2Ch3Cooh
Beachten Sie, dass beim Zuzufügen des Wassermoleküls zwei Essigsäuremoleküle freigesetzt werden. Die umgekehrte Reaktion kann jedoch bei Essigsäure nicht auftreten:
Kann Ihnen dienen: Flüssigkeits-Dampfbalance2ch3Cooh => (cho3CO)2Oder + h2Oder (passiert nicht)
Es ist notwendig, auf einen anderen synthetischen Weg zurückzugreifen. Dicarbonsäuren können dies dagegen durch Erhitzen tun; Aber es wird im nächsten Abschnitt erklärt.
Chemische Reaktionen
Hydrolyse
Eine der einfachsten Reaktionen von Anhydriden ist ihre Hydrolyse, die gerade für Essigsäureanhydrid gezeigt wurde. Zusätzlich zu diesem Beispiel gibt es das von Schwefelsäureanhydrid:
H2S2ENTWEDER7 + H2Oder 2h2SW4
Hier haben Sie einen anorganischen Säureanhydrid. Beachten Sie das für h2S2ENTWEDER7 (Auch Disulfursäure genannt), die Reaktion ist reversibel, so2SW4 Konzentrat führt zur Bildung seines Anhydrids. Wenn andererseits eine verdünnte Lösung von H ist2SW4, Es wird so veröffentlicht3, Schwefelanhydrid.
Veresterung
Säureanhydride reagieren mit Alkoholen, mit Pyridin in der Mitte, um zu einem Ester und einer Carbonsäure zu führen. Beispielsweise wird die Reaktion zwischen Essigsäureanhydrid und Ethanol berücksichtigt:
(CH3CO)2Oder + ch3CH2Oh => cho3CO2CH2CH3 + CH3Cooh
So bilden Sie den Ethylethanester, CH3CO2CH2CH3, und Ethansäure (Essigsäure).
Praktisch ist das Ersatz des Wasserstoffs der Hydroxylgruppe durch eine Aquilus -Gruppe:
R1-Oh => r1-OCOR2
Im Fall von (ch3CO)2Oder Ihre Acilo -Gruppe ist der -Coch3. Daher wird gesagt, dass die OH -Gruppe eine Akilation durchläuft. Akilation und Veresterung sind jedoch keine austauschbaren Konzepte. Akilation kann direkt in einem aromatischen Ring auftreten, der als Friedel-Crafts-Akilationsname bekannt ist.
Somit werden Alkohole in Gegenwart von Säureanhydriden durch Akilation verärgert.
Andererseits reagiert nur eine der beiden Säuregruppen mit Alkohol, die andere bleibt mit Wasserstoff, die eine Carbonsäure bilden. das im Fall von (cho3CO)2Oder es ist Ethansäure.
Inmitten
Säureanhydride reagieren mit Ammoniak oder Aminen (primär und sekundär), um Amide zu führen. Die Reaktion ist der neu beschriebenen Veresterung sehr ähnlich, aber die ROH wird durch ein Amin ersetzt; Zum Beispiel eine sekundäre Amina, r2NH.
Wieder die Reaktion zwischen (CH3CO)2Oder und Diethylamin ET2NH:
(CH3CO)2O + 2et2Nh => ch3Fortsetzung2 + CH3Gurren- +NH2ET2
Und Diethilacetamid werden gebildet, Cho3Fortsetzung2, und ein carbboxyliertes Ammoniumsalz, Cho3Gurren- +NH2ET2.
Obwohl die Gleichung etwas schwer zu verstehen scheint, reicht es aus, zu beobachten, wie die Gruppe -Koch3 Ersetzen Sie das H eines ET2NH, um die Amida zu bilden:
ET2Nh => et2NCOCH3
Mehr als eine Amidierung ist die Reaktion immer noch Akilation. Alles ist in diesem Wort zusammengefasst; Diesmal erleidet die Amina Akilation und nicht Alkohol.
Wie sind Anhydride??
Anorganische Anhydride werden gebildet, indem das Element mit Sauerstoff reagiert. Wenn also das Element metallisch ist, wird ein grundlegendes metallisches Oxid gebildet; Und wenn es nicht metallisch ist, wird ein nicht -metallisches Oxid oder ein Säurerhydrid gebildet.
Es kann Ihnen dienen: Clausius-Clapeyron-Gleichung: Wofür es, Beispiele, ÜbungenBei organischen Anhydriden ist die Reaktion eine andere. Zwei Carboxylsäuren können sich nicht direkt verbinden, um Wasser freizusetzen und Anhydridsäure zu bilden. Die Beteiligung einer Verbindung, die noch nicht erwähnt wurde: Das Acylchlorid, RCOCL ist notwendig.
Carboxylsäure reagiert mit saurem Chlorid und erzeugt das jeweilige Anhydrid- und Wasserstoffchlorid:
R1Cocl + R2Cooh => (r1Co) oder (cor2) + Hcl
CH3Cocl + ch3Cooh => (cho3CO)2O + HCl
A ch3 kommt aus der Acetylgruppe, Cho3Co- und der andere ist bereits in Essigsäure vorhanden. Die Auswahl eines spezifischen Säurechlorids sowie Carbonsäure kann die Synthese eines symmetrischen oder asymmetrischen Anhydrids hervorrufen.
Zyklische Anhydride
Im Gegensatz zu den anderen Carbonsäuren, die saures Chlorid benötigen, können Dicarbonsäuren in ihrem entsprechenden Anhydrid kondensieren. Dazu ist es notwendig, sie zu erhitzen, um die Freisetzung von H zu fördern2ENTWEDER. Zum Beispiel wird die Bildung von phthalischem Anhydrid aus Photalsäure gezeigt.
 Fthalische Anhydridbildung. Quelle: Jü [Public Domain] aus Wikimedia Commons
Fthalische Anhydridbildung. Quelle: Jü [Public Domain] aus Wikimedia Commons Beachten Sie, wie der Pentagonalring abgeschlossen ist, und der Sauerstoff, der beide Gruppen C = O verbindet, ist ein Teil davon; Dies ist ein zyklischer Anhydrid. Es ist auch ersichtlich, dass das phthalische Anhydrid ein symmetrischer Anhydrid ist, da so viel r1 wie r2 Sie sind identisch: ein aromatischer Ring.
Nicht alle Dicarboxylsäuren sind in der Lage, ihren Anhydrid zu bilden, denn wenn ihre Cooh -Gruppen sehr getrennt sind, sind sie gezwungen, zunehmend größere Ringe zu vervollständigen. Der größte Ring, der gebildet werden kann.
Nomenklatur
Wie werden Anhydride benannt?? Abgesehen von den anorganischen, relevanten für Oxidprobleme relevant, hängen die Namen von organischen Anhydriden bisher von der Identität von R ab1 und r2; das heißt von seinen Acylgruppen.
Wenn die beiden R gleich sind, reicht es aus, das Wort "Säure" durch "Anhydrid" im jeweiligen Namen von Carboxylsäure zu ersetzen. Und wenn im Gegenteil die beiden R unterschiedlich sind, werden sie in alphabetischer Reihenfolge benannt. Um zu wissen, wie man es nennt.
Das CH3CO)2Oder es ist symmetrisch, da r1= R2 = Ch3. Es stammt von Essig oder Ethansäure, sodass sein Name nach der vorherigen Erklärung folgt: Essig oder ethanoanhydrid. Das gleiche passiert mit dem gerade erwähnten fthalischen Anhydrid.
Angenommen, Sie haben den folgenden Anhydrid:
CH3CO (O) COCH2CH2CH2CH2CH2CH3
Die Acetylgruppe links stammt von Essigsäure, und die rechts von Heptansäure. Um diesen Anhydrid zu nennen, müssen Sie seine R -Gruppen in alphabetischer Reihenfolge ernennen. Sein Name ist also: Heptanoic Essigsäureanhydrid.
Anwendungen
Anorganische Anhydride haben endlose Anwendungen aus der Synthese und Formulierung von Materialien, Keramik, Katalysatoren, Zementen, Elektroden, Düngemitteln usw., Bis zur Beschichtung der Erdkruste mit seinen Tausenden von Eisen- und Aluminiummineralien und dem Kohlendioxid, das von lebenden Organismen ausgeatmet wurde.
Kann Ihnen dienen: Dekantierung: Konzept, Beispiele und TypenSie repräsentieren die Startquelle. Einer der wichtigsten Anhydride ist die von Carbonic, Co2. Es ist zusammen mit dem Wasser für die Photosynthese unerlässlich. Und auf industrieller Ebene das SO3 Es ist wichtig, da der beklagte Schwefelsäure daraus erhalten wird.
Vielleicht ist Anhydrid mit mehr Anwendungen und zu haben (solange es ein Leben gibt) eins von Phosphorsäure: Adenosintryposphat, besser bekannt als ATP, in DNA und "Energiewährung" des Stoffwechsels vorhanden.
Organische Anhydride
Säureanhydride reagieren durch Acylierung, entweder auf einen Alkohol, bildet einen Ester, ein Amin, das zu einem Amida oder einem aromatischen Ring führt.
Es gibt Millionen dieser Verbindungen und Hunderttausende von Carboxylsäureoptionen zur Herstellung eines Anhydrids; Daher wachsen synthetische Möglichkeiten drastisch.
Eine der Hauptanwendungen besteht daher darin, eine Säuregruppe in eine Verbindung einzubeziehen, wodurch eine der Atome oder Gruppen ihrer Struktur ersetzt wird.
Jedes Dioxid hat getrennt seine eigenen Anwendungen, aber im Allgemeinen reagieren sie alle auf ähnliche Weise. Aus diesem Grund werden diese Arten von Verbindungen verwendet, um Polymerstrukturen zu modifizieren und neue Polymere zu erzeugen. das heißt, Copolymere, Harze, Beschichtungen usw.
Zum Beispiel wird es Essigsäureanhydrid verwendet, um alle Cellulose -OH -Gruppen zu Acetillation (niedrigeres Bild). Damit wird jeder h des OH durch eine Acetylgruppe ersetzt, Coch3.
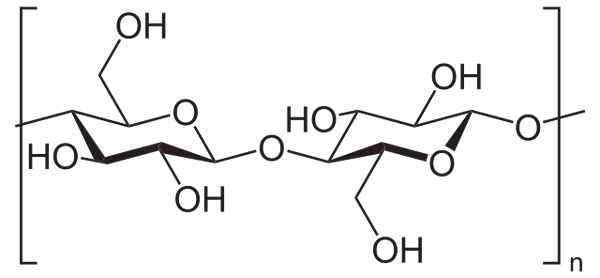 Zellulose. Quelle: Neurotoger [Public Domain] aus Wikimedia Commons
Zellulose. Quelle: Neurotoger [Public Domain] aus Wikimedia Commons Auf diese Weise wird das Celluloseacetatpolymer erhalten. Die gleiche Reaktion kann mit anderen polymeren Strukturen mit NH -Gruppen skizziert werden2, Auch anfällig für Akilation.
Diese Akilationsreaktionen sind auch für die Arzneimittelsynthese wie Aspirin (Säure) nützlich Acetylsalicylisch).
Beispiele
Es wird gezeigt, dass sie einige andere Beispiele für organische Anhydrien beenden. Obwohl sie sie nicht erwähnen werden, können Sauerstoffatome durch Schwefel ersetzt werden, wodurch sulfurisierte Anhydride oder sogar Phosphor angezeigt werden.
-C6H5CO (O) Kochen6H5: Benzoicanhydrid. Gruppe c6H5 repräsentiert einen Benzolring. Seine Hydrolyse produziert zwei Benzoesäuren.
-HCO (O) COH: Formikanhydrid. Seine Hydrolyse erzeugt zwei Ameisensäuren.
- C6H5CO (O) COCH2CH3: Propanoischer Benzo -Anhydrid. Seine Hydrolyse produziert Benzoik- und Propansäuren.
-C6HelfCO (O) Kochen6Helf: Cyclohexanocroboxylicanight Anhydrid. Im Gegensatz zu aromatischen Ringen sind diese ohne doppelte Verbindungen gesättigt.
-CH3CH2CH2CO (O) COCH2CH3: Propanoischer Butananhydrid.
Succinicanhydrid
 Succinicanhydrid. Quelle: Ninjatacoshell [Public Domain] aus Wikimedia Commons
Succinicanhydrid. Quelle: Ninjatacoshell [Public Domain] aus Wikimedia Commons Hier haben Sie eine weitere zyklische, abgeleitet von Succinsäure, eine Dicarboxylsäure. Beachten Sie, wie die drei Sauerstoffatome die chemische Natur dieser Art von Verbindung verraten.
Der Anhydrid Maleico ist dem der Succinic sehr ähnlich, mit dem Unterschied, dass es eine doppelte Bindung zwischen den Kohlenstoffen gibt, die die Basis des Pentagons bilden.
Glutarieranhydrid
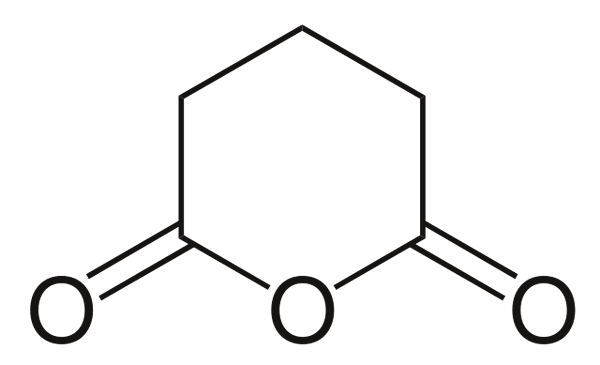 Glutarieranhydrid. Quelle: Choij [Public Domain] aus Wikimedia Commons
Glutarieranhydrid. Quelle: Choij [Public Domain] aus Wikimedia Commons Und schließlich wird der Anhydrid von Glutarsäure gezeigt. Dies unterscheidet alle anderen strukturell, indem er aus einem sechseckigen Ring besteht. Wieder stechen die drei Sauerstoffatome in der Struktur ab.
Andere komplexere Anhydride können immer durch die drei Sauerstoffatome nachgewiesen werden.
Verweise
- Anhydrid. Enclyclopaedia Britannica. Erholt von: Britannica.com
- Säureanhydrid -Definition in der Chemie. Erholt von: thoughtco.com

