Säuresäureanhydride, wie gebildet werden, Anwendungen und Beispiele

- 653
- 35
- Lewis Holzner
Der Säureanhydride Sie gelten für die Vielzahl von Verbindungen organischer Herkunft von großer Bedeutung, die existieren. Diese werden als Moleküle dargestellt, die zwei Säuregruppen haben (organische Substituenten, deren Formel RCO ist, wobei R eine Kohlenstoffkette ist), die mit demselben Sauerstoffatom vereint ist.
Es gibt auch eine Klasse von Säureanhydriden, die allgemein gefunden werden: Carboxylanhydride, die genannt, weil die Startsäure eine Carbonsäure ist. Um diejenigen dieser Art zu nennen, deren Struktur symmetrisch ist, muss nur ein Austausch von Begriffen erfolgen.

Die saure Expression muss in der Nomenklatur ihrer ursprünglichen Carboxylsäure durch den Anhydrid -Begriff "ohne Wasser" ersetzt werden, ohne den Rest des Namens des gebildeten Moleküls zu verändern. Diese Verbindungen können auch basierend auf einer oder zwei Säuregruppen aus anderen organischen Säuren erzeugt werden, wie Phosphonsäure oder Sulfonsäure.
In ähnlicher Weise können saure Anhydride basierend auf einer Anorganinsäure wie Phosphorsäure verursacht werden. Die physikalischen und chemischen Eigenschaften, seine Anwendungen und andere Eigenschaften hängen jedoch von der durchgeführten Synthese und der Anhydridstruktur ab.
[TOC]
Wie werden saure Anhydride gebildet??
Einige Säureanhydride stammen aus verschiedenen Arten, entweder im Labor oder in der Branche. In der industriellen Synthese wird Essigsäureanhydrid als Beispiel genommen, das hauptsächlich durch den Karbonilationsprozess des Methylacetatmoleküls erzeugt wird.
Ein weiteres Beispiel für diese Synthese ist das von Anhydrid Maleico, das durch die Oxidation des Benzolmoleküls oder Butans erzeugt wird.
Es kann Ihnen dienen: Zinkhydroxid (Zn (OH) 2)Bei der Synthese von Säureanihydriden im Labor liegt der Schwerpunkt auf der Dehydration der entsprechenden Säuren, wie der Produktion des ethanischen Anhydrids, bei dem zwei Moleküle von Ethainsäure dehydriert werden, um die erwähnte Verbindung zu erzeugen.
Eine intramolekulare Dehydration kann ebenfalls auftreten; Das heißt, innerhalb desselben Moleküls einer Säure mit zwei Carboxylgruppen (oder Dicarboxylikum), aber wenn das Gegenteil auftritt und ein Säureanhydrid auf einer Hydrolyse litt.
Säuresäureanhydride, deren Acylsubstituenten gleich sind, während in Anhydriden dieser Art, die als gemischt angesehen wird, sind unterschiedliche Moleküle unterschiedlich.
Diese Spezies werden jedoch auch erzeugt, wenn eine Reaktion zwischen einem sauren Halur (dessen allgemeine Formel ein (rcox)) mit einem Carboxylatmolekül (deren allgemeine Formel R'coOo-))))) erzeugt wird)))))))))))))))))))))))))))))))))))))). [2]
Allgemeine Formel
Die allgemeine Formel von Säureanhydriden ist (rc (o))2Oder, was in dem Bild zu Beginn dieses Artikels besser beobachtet wird.
Zum Beispiel für Essigsäureanhydrid (von Essigsäure) ist die allgemeine Formel (CH3CO)2Oder, ähnlich für viele andere ähnliche säureanhydride schreiben.
Wie oben erwähnt, haben diese Verbindungen fast den gleichen Namen wie ihre Vorläufersäuren, und das einzige, was sich verändert.
Anwendungen
Säuresäureanhydride haben viele Funktionen oder Anwendungen, je nach Feld, das untersucht wird, da sie eine hohe Reaktivität aufweisen, können sie Vorläuferreagenzien oder Teil vieler wichtiger Reaktionen sein.
Kann Ihnen dienen: PyrolyseEin Beispiel hierfür ist die Branche, in der Essigsäureanhydrid in großen Mengen erzeugt wird, da es die einfachste Struktur ist, die isoliert werden kann. Dieser Anhydrid wird als wichtiges organisches Reagenz wie Acetatester verwendet.
Industrielle Nutzung
Andererseits wird der Anhydrid Maleico mit einer zyklischen Struktur gezeigt, die zur Herstellung von Abdeckung für den industriellen Gebrauch und als Vorläufer einiger Harze durch den Copolymeterisierungsprozess mit Stretusmolekülen verwendet wird. Darüber hinaus dient diese Substanz als Dienophil, wenn die Diels-Alder-Reaktion durchgeführt wird.
In ähnlicher Weise gibt es Verbindungen, die zwei Säuresäure -Moleküle in ihrer Struktur haben, wie ethystarboxylisch oder Dianhydriddianhydrid.
Zusätzlich zu diesen gibt es ein gemischtes Anhydrid namens 3'-phosphoadenosín-5'-Phosphosulfat aus Phosphor- und Schwefelsäuren.
Beispiele für Säureanhydride
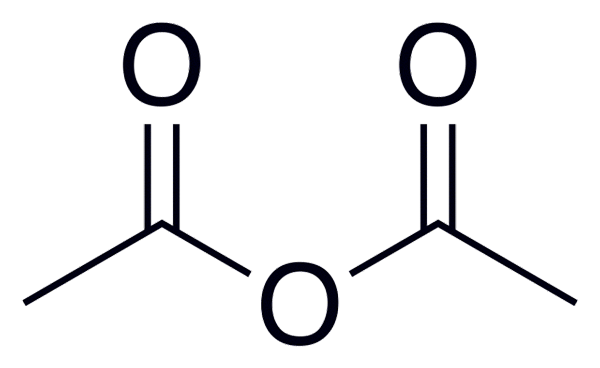 Essigsäureanhydrid
Essigsäureanhydrid Im Folgenden finden Sie eine Liste mit den Namen einiger saurer Anhydride, um einige Beispiele für diese wichtigen Verbindungen in der organischen Chemie zu geben, die Verbindungen linearer Struktur oder Ringe mehrerer Mitglieder bilden können:
- Essigsäureanhydrid.
- Propanoischer Anhydrid.
- Benzoikumanhydrid.
- Maleicoanhydrid.
- Succinicanhydrid.
- Fthalischer Anhydrid.
- Naphthalente -tracarboxylisch Dianhydrid.
- Ethytertarboxyldianhydrid.
- Benzoquinonteterarboxylic Dianhydrid.
So wie diese Anhydride mit Sauerstoff gebildet werden, werden andere Verbindungen angegeben, bei denen ein Schwefelatom sowohl in der Carbonylgruppe als auch in zentraler Sauerstoff Sauerstoff ersetzen kann, wie zum Beispiel:
Kann Ihnen dienen: Acetanylid (C8H9no)- Tioacetionischer Anhydrid (wählen3C (s)2ENTWEDER)
Es gibt sogar den Fall von zwei Säuremolekülen, die Verbindungen mit demselben Schwefelatom bilden. Diese Verbindungen werden genannt Tioanhydride, nämlich:
- Essiges tioanhydrid ((CH)3CO)))2S)
Verweise
- Wikipedia. (2017). Wikipedia. Abgerufen von.Wikipedia.Org
- Johnson, a. W. (1999). Einladung zur organischen Chemie. Aus Büchern erholt.Google.CO.gehen.
- Acton, q. ZU. (2011). Säureanhydridhydrolas: Fortschritte in der Forschung und Anwendung. Aus Büchern erholt.Google.CO.gehen
- Bruckner, r., Und Harmata, m. (2010). Organische Mechanismen: Reaktionen, Stereochemie und Synthese. Aus Büchern erholt.Google.CO.gehen
- Kim, j. H., Gibb, h. J., und Iannucci, zu. (2009). Cyclonsäureanhydride: Aspekte der menschlichen Gesundheit. Aus Büchern erholt.Google.CO.gehen
- « Arten von Batterien, Eigenschaften und Reaktionen
- Julia Pastrana -Biographie, Krankheit, Beziehungen »

