Antimongeschichte, Struktur, Eigenschaften, Verwendung und Risiken

- 2744
- 539
- Tizian Liebich
Er Antimon Es ist ein glänzendes, Silbermetalloid und mit einem bestimmten blauen Farbton. Sein solide ist auch durch sehr spröde und von Plattenepithelung geprägte Textur gekennzeichnet. Es gehört zu Gruppe 15 des Periodenzüchtertabels unter der Leitung von Stickstoff. Nach dem Wismut (und dem Moskau) ist es das schwerste Element der Gruppe.
Es wird durch das chemische SB -Symbol dargestellt. In der Natur befindet es sich hauptsächlich in Stabit- und Ullmannit -Mineralien, deren chemische Formeln SB sind2S3 und Nisbs. Seine hohe Tendenz, Sulfide anstelle von Oxiden zu bilden, liegt daran, dass es chemisch weich ist.
 Kristalline Antimon. Quelle: Beste Sci-FATCs [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Kristalline Antimon. Quelle: Beste Sci-FATCs [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Andererseits ist das Antimon auch physikalisch weich und bietet eine Härte von 3 auf der MOHS -Skala. Es ist bei Raumtemperatur stabil und reagiert nicht mit Luftsauerstoffgassen. Aber wenn er in Gegenwart von Sauerstoff erhitzt wird, bildet er das Antimon -Trioxid SB2ENTWEDER3.
Es ist auch resistent gegen die Wirkung schwacher Säuren; Aber heiß wird von Salpetern und Salzsäuren angegriffen.
Das Antimon hat zahlreiche Anwendungen, darunter in Legierungen mit Blei und Zinn, bei der Herstellung von Batterien für Fahrzeuge, niedrige Reibungsmaterialien usw.
Dieses Metalloid hat das seltene Besitz, um das Volumen zu erhöhen, wenn sie erstarrt werden, und ermöglicht es seinen Legierungen, den Raum vollständig zu belegen, der zum Herstellen des Instruments verwendet wird.
[TOC]
Geschichte Ihrer Entdeckung
BC
Es gibt Hinweise darauf, dass von 3100 bis.C, Antimonsulfid wurde als Kosmetik in Ägypten verwendet. In Mesopotamien wurden der aktuelle Irak, Überreste einer Vase und ein weiteres Artefakt festgestellt, die angeblich zwischen 3000 und 2200 Jahren zu Datum ist.C, in dem es in seiner Antimonausarbeitung verwendet wurde.
Einführung des Begriffs
Roman Erúdito Plinio El Viejo (23-79 D.c) beschrieb die Verwendung von Antimon, die er Estibio nannte. Alchemist Abu Mussa Jahir Ibn Hayyan (721-815) wird auf die Einführung des Begriffs Antimon zur Ernennung des Elements zurückgeführt.
Er verwendete die folgende Etymologie: 'Anti' als Synonym für die Verweigerung und 'mono' für nur für. Dann wollte er betonen, dass das Antimon nicht allein in der Natur war. Es ist bereits bekannt, dass es Teil von Schwefelmineralien ist, die wie andere Elemente wie andere Elemente.
Erhalten
Es wird angenommen. Der italienische metallurgische Vannocio Biringucio im Buch der Pyrotechnik (1540) beschreibt eine Methode, um das Antimon zu isolieren.
Der deutsche Chemiker Andreas Libavius (1615) erreichte unter Verwendung einer Gussmischung aus Eisen, Antimonsulfid, Salz und Kaliumtartrato die Produktion eines kristallinen Antimon.
Der erste detaillierte Bericht über das Antimon wurde 1707 vom französischen Chemiker Nicolas Lemery (1645-1715) in seinem auf dem Antimon behandelten Buch erstellt.
Kann Ihnen dienen: Kupferchlorid (i) (CUCL): Struktur, Eigenschaften, verwendetAntimonstruktur
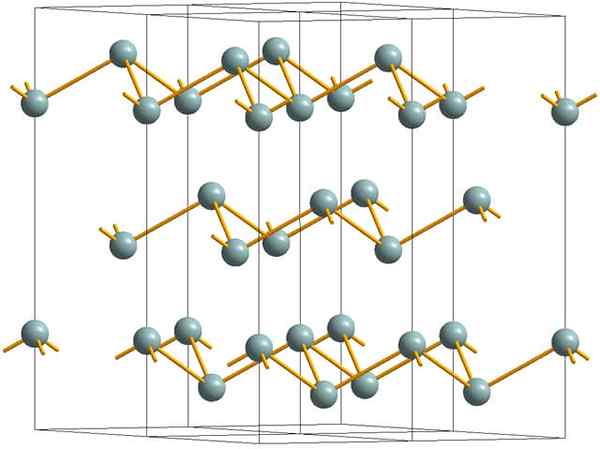 Faltige Schichten, die die kristalline Struktur des metallischen oder silbernen Antimons ausmachen. Quelle: MaterialScientist [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Faltige Schichten, die die kristalline Struktur des metallischen oder silbernen Antimons ausmachen. Quelle: MaterialScientist [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Das obere Bild zeigt die Struktur der von Arsenatomen angewendeten Faltenschichten. Das graue Antimon, besser bekannt als Metallic -Antimon, nimmt diese Struktur ebenfalls an. Es wird gesagt, dass es "faltig" ist, weil es SB -Atome gibt, die aus der Ebene aus der Schicht steigen und fallen.
Diese Schichten, obwohl sie für die Photonen verantwortlich sind, die mit ihm interagieren, um Silberglitzer zu glänzen und das Antimon als Metall zu machen, ist die Wahrheit, dass die Kräfte, die sie vereinen, schwach sind; Von hier zu den scheinbaren Metallfragmenten von SB können leicht gezeigt werden und sind spröde oder Sneaker.
Darüber hinaus reichen SB -Atome in faltigen Schichten nicht aus, um ihre Atomorbitale zu gruppieren und so ein Band zu erstellen, das eine elektrische Leitung ermöglicht.
Wenn Sie eine graue Kugel einzeln sehen, können Sie sehen, dass es drei SB-SB-Links hat. Aus einer höheren Ebene war der SB in der Mitte eines Dreiecks zu sehen, wobei drei SB an seinen Eckpunkten liegen. Das Dreieck ist jedoch nicht flach und hat zwei Ebenen oder Böden.
Die laterale Reproduktion solcher Dreiecke und ihrer Links legt faltige Schichten fest, die zu Rhomboébic -Kristallen ausgerichtet sind.
Allotropie
Die neu beschriebene Struktur entspricht dem grauen Antimon, dem stabilsten seiner vier Alotrope. Die anderen drei Alotrope (schwarz, gelb und explosiv) sind metastabil; Das heißt, sie können unter sehr strengen Bedingungen existieren.
Es gibt nicht zu viele Informationen über seine Strukturen. Es ist jedoch bekannt, dass das schwarze Antimon amorph ist, so dass seine Struktur chaotisch und kompliziert ist.
Das gelbe Antimon ist unter -90ºC stabil, verhält es sich als nicht -metallisches Element und kann vermutet werden, das aus kleinen SB -Agglomeraten besteht4 (ähnlich wie Phosphor); Wenn es erhitzt wird, verwandelt es sich in das schwarze Alotrope.
Und in Bezug auf das explosive Antimon besteht es aus einem gallertartigen Tank, der während der Elektrolyse einer wässrigen Lösung eines Antimon -Halogenids auf der Kathode gebildet wird.
Bis zum geringsten starken Rubb.
Eigenschaften
Atomares Gewicht
121,76 g/mol.
Ordnungszahl
51.
Elektronische Konfiguration
[Kr] 4d105s25 p3.
Oxidationszustände
-3, -2, -1, +1, +2, +3, +4, +5.
Physische Beschreibung
Glänzendes Silber, spröde, Plattenepitheloberfläche mit einem blauen Farbton. Es kann auch als schwarzer Staub erscheinen.
Schmelzpunkt
630,63 ºC.
Siedepunkt
1.635 ºC.
Dichte
-6.697 g/cm3 bei Raumtemperatur.
-6,53 g/cm3 Im flüssigen Zustand, die Temperatur gleich oder höher zum Schmelzpunkt.
Fusionshitze
19.79 kJ/mol.
Verdampfungswärme
193.43 kJ/mol.
Kann Ihnen dienen: Kupfersulfid: Struktur, Eigenschaften, verwendetMolkalorienkapazität
25.23 j/mol.K
Elektronegativität
2.05 (Pauling -Skala).
Atomradio
140 Uhr.
Härte
Es ist ein weiches Element mit einer Härte von 3 auf der MOHS -Skala und kann durch Glas zerkratzt werden.
Stabilität
Es ist stabil bei Raumtemperatur und hat keine Oxidation. Es ist auch resistent gegen Säureangriffe.
Isotope
Es hat zwei stabile Isotope: 121SB und 123Sb. Darüber hinaus gibt es 35 radioaktive Isotope. Das radioaktive Isotop 125SB ist derjenige mit dem größten halben Leben: 2,75 Jahre. Im Allgemeinen emittieren radioaktive Isotope β -Strahlung+ und β-.
Elektrische und thermische Leitfähigkeit
Antimon ist ein schlechter Leiter für Wärme und Elektrizität.
Chemische Reaktivität
Kann den Wasserstoff nicht aus verdünnten Säuren verdrängen. Ionische Komplexform mit organischen und anorganischen Säuren. Das metallische Antimon reagiert nicht mit der Luft, sondern wird schnell in Oxid in die nasse Luft umgewandelt.
Halogene und Sulfide oxidieren das Antimon leicht, wenn der Prozess bei hohen Temperaturen auftritt.
Anwendungen
Legierungen
Das Antimon wird in Legierung mit Blei für die Erstellung von Platten für Autobatterien verwendet, die den Widerstand der Platten sowie die Merkmale der Lasten verbessert.
Blei- und Zinnlegierung wurde verwendet, um die Eigenschaften der Schweißnähte sowie die der Tracer -Kugeln und -Patronen zu verbessern. Es wird auch in Legierungen für die elektrische Kabelbeschichtung verwendet.
Das Antimon wird in Antifriktionslegierungen verwendet, bei der Herstellung von Peel- und Härtungslegierungen mit geringem Zinngehalt bei der Herstellung von Organen und anderen Musikinstrumenten.
Es präsentiert das Merkmal, das mit dem Wasser geteilt wird, das Volumen erhöht, wenn sie kondensiert; Das Antimon, das in Legierungen mit Blei und Zinn vorhanden ist, füllt alle Räume der Formen und verbessert die Definition der mit diesen Legierungen hergestellten Strukturen.
Feuerdämmend
Antimon -Trioxid wird zur Ausarbeitung von Zogiphe -Verbindungen verwendet, immer in Kombination mit halogenierten Feuerschutzmitteln, Bromuros und Chlorid.
Feuerwaffenhelfer können mit Sauerstoff und radikalen Atomen reagieren, was das Feuer hemmt. Diese Zündhelfer werden in Kleidung für Kinder, Spielzeug, Flugzeuge und in Autositzen verwendet.
Sie werden auch in Polyesterharzen und in Glasfaserverbänden für gebrauchte Gegenstände wie leichte Flugzeugmotoren hinzugefügt.
Antimon -Verbindungen, die als Feuerwehrverzögere verwendet werden, umfassen: Antimon Oxychlorid, SBOCL; Antimon Pentoxid, SBO5; Antimontrichlorid, SBCL3; und Antimon Trioxid, SBO3.
Elektronikfeld
Es wird bei der Herstellung von Halbleitern, Dioden, mittleren Infrarotdetektoren und bei der Ausarbeitung von Transitoren verwendet. Hochreinheit Antimon, verwendet in der Halbleitertechnologie, wird durch Reduktion von Antimonverbindungen mit Wasserstoff erhalten.
Kann Ihnen dienen: Faktoren, die die Löslichkeit beeinflussenMedizin und Tierarzt
Antimon -Verbindungen werden in der Medizin seit der Antike wie Eméticas und Antiprotozoen verwendet. Kaliumtartrato (ästhetische Tartar) wurde für lange Zeit als antisquisosomal verwendet. Wird auch als expektoranter, diaphoretisch und emético verwendet.
Antimonsalze wurden auch bei der Konditionierung der Haut von Wiederkäuern verwendet. wie aniomalin und Lithium und Antimon Tiomalat.
Meglumin -Antimon ist ein Medikament, das bei der Behandlung von Leishmaniasis in externen Scheinwerfern von Haustieren verwendet wird. Obwohl die therapeutischen Vorteile knapp waren.
Pigmente und Gemälde
Antimon -Verbindungen werden zur Ausarbeitung von Farben und Opacifier in Emaille verwendet. Sie werden auch in Bermellón-, Gelb- und Orangenpigmenten verwendet, bei denen es sich um Produkte der langsamen Oxidation von Antimonsulfiden handelt.
Einige seiner organischen Salze (Tartratos) werden in der Textilindustrie verwendet, um im Zusammenhang mit bestimmten Farbstoffen zu helfen.
Antimon -Sulfid wurde im alten Ägypten als kosmetisch bei der Verdunkelung der Augen eingesetzt.
Andere Verwendungen
Einige Antimonsalze werden als Beschichtungsmittel verwendet, um mikroskopische Blasen zu eliminieren, die auf Fernsehbildschirmen gebildet werden. Antimonionen interagieren mit Sauerstoff und beseitigen ihre Tendenz, Blasen zu bilden.
Antimon -Sulfid (III) wird in den Köpfen einiger Sicherheitsübereinstimmungen verwendet. Antimon -Sulfid wird auch zur Stabilisierung des Reibungskoeffizienten der in Autorbremsbelag verwendeten Materialien verwendet.
Das Isotop 124SB wird zusammen mit Beryllium als Neutronenquelle mit einem Energiedurchschnitt von 24 keV verwendet. Darüber hinaus wird Antimon als Katalysator in der Kunststoffproduktion verwendet.
Risiken
Es ist ein spröde Element, so dass während der Manipulation ein Schadstoffpulver der Umwelt auftreten kann. Bei Arbeitern, die Antimonstaub, Dermatitis, Renitis, Entzündung von hohem Atemweg und Bindehautentzündung ausgesetzt sind, wurden beobachtet.
Pneumokoniose wurde beschrieben, manchmal kombiniert mit obstruktiven Lungenveränderungen, nach längeren Ausstellungen.
Antimon -Trioxid kann die Herzfunktion schädigen, die sterblich sein können.
Bei Menschen, die diesem Element ausgesetzt sind, wurde das Vorhandensein von pustulären Hautinfektionen beobachtet, wesentlich.
Die kontinuierliche niedrige Dosisaufnahme dieses Metalls kann durch Durchfall und Magengeschwüre führen. Auch die maximal erträgliche Konzentration in der Luft beträgt 0,5 mg/m3.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Manny. (11. März 2009). Gelbes Antimon und explosives Antimon. Abgerufen von: Antimonyproperties.Blogspot.com
- Prof. Ernst Cohen und J. C. Van den Bosch. (1914). Die Allotropie des Antimon. Verfahren Royal Acad. Amsterdam. Vol. Xvii.
- Wikipedia. (2019). Antimon. Abgerufen von: in.Wikipedia.Org
- Advameg, Inc. (2019). Antimon. Erholt von: ChemistryExplaed.com
- Mc'oneal Sabre. (15. September 2018). Chemie: Eigenschaften und Anwendung von SB-Antimony. Erholt von: Medium.com
- « Biogeographiegeschichte, welche Studien und Forschungsbeispiele
- Hörverschmutzung verursachen Ursachen, Konsequenzen, Lösungen »

