Anthraceno Was ist Struktur, Eigenschaften, verwendet
- 3861
- 458
- Frederike Birkemeyer
Er Anthracen Es ist ein polyzyklischer aromatischer Kohlenwasserstoff (PAH), der durch die Fusion von drei Benzolringen gebildet wird. Es ist eine farblose Verbindung, aber unter der Bestrahlung von ultraviolettem Licht erhält eine fluoreszierende blaue Farbe. Das Anthracen untermauert leicht.
Es ist ein weißer Feststoff, kann aber auch als unlolinische farblose Kristalle auftreten, einen weichen aromatischen Geruch. Das feste Anthracen ist im Wasser praktisch unlöslich und in organischen Lösungsmitteln teilweise löslich, insbesondere in Kohlenstoffdisulfid, CS2.
Es wurde 1832 von August Laurent und Jean Dumas mit dem Teer als Rohstoff entdeckt. Dieses Material wird weiterhin in der Anthracenproduktion verwendet, da es 1,5 % der aromatischen Verbindung enthält. Es kann auch aus Benzoquinon synthetisiert werden.
Es kommt in der Umwelt als Produkt der teilweisen Verbrennung fossiler Kohlenwasserstoffe vor. Es wurde in Trinkwasser, in der atmosphärischen Luft, in den Flüchtlingen der Kraftfahrzeuge und im Rauch der Zigaretten gefunden. Erscheint auf der EPA -Liste (United States Environmental Protection Agency) der wichtigsten Umweltschadstoffe.
Anthracenstruktur
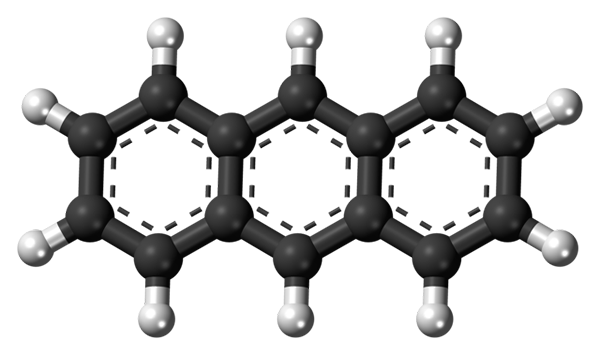 Die drei aromatischen Anthracenerringe. Quelle: Jynto [CC0]
Die drei aromatischen Anthracenerringe. Quelle: Jynto [CC0] Das obere Bild zeigt die Struktur des Anthracen. Wie zu sehen ist, gibt es drei Sechs -Kohlenstoff -aromatische Ringe; Dies sind Benzolringe. Die gepunkteten Linien zeigen die in der Struktur vorhandene Aromatizität an.
Alle Kohlenstoffe haben SP -Hybridisierung2, Das Molekül befindet sich also in derselben Ebene. Daher kann Anthracen als kleines und aromatisches Blatt betrachtet werden.
Beachten Sie, dass Wasserstoffatome (weiße Kugeln) vor einer Reihe chemischer Reaktionen praktisch entdeckt werden.
Intermolekulare Kräfte und kristalline Struktur
Anthracen. Zum Beispiel können Sie sehen, dass zwei dieser "Blätter" die Elektronen ihrer π -Wolke (die aromatischen Zentren der Ringe) verbinden und bewegen, sie schaffen es, zusammen zu bleiben.
Eine weitere mögliche Wechselwirkung besteht darin. Und daher üben diese Attraktionen einen gerichteten Effekt aus, der Anthracen -Moleküle im Raum leiten.
Kann Ihnen dienen: GeschwindigkeitskonstanteSomit wird Anthracen so geordnet, dass es ein langes Strukturmuster annimmt; Und deshalb kann es in einem monoklinen System kristallisieren.
Vermutlich weisen diese Kristalle gelblich -färbliche Produkte ihrer Oxidation nach Antraquinona auf; Das ist ein aus Anthracen abgeleiteter, dessen Festes gelb ist.
Eigenschaften
Chemische Namen
-Anthracen
-Paranaftalen
-Anthracin
-Grünes Öl
Molekularformel
C14H10 oder (c6H4CH)2.
Molekulargewicht
178,234 g/mol.
Physische Beschreibung
Weiß oder hellgelb fest. Monokline Kristalle Produkt der Rekristallisation bei Alkohol.
Farbe
Wenn es rein ist, ist das Anthracen farblos. Mit gelb hellgelben Kristallen geben Fluoreszenz einer blauen Farbe. Sie können auch bestimmte gelbliche Töne präsentieren.
Geruch
Weiche aromatische.
Siedepunkt
341,3 ºC.
Schmelzpunkt
216 ºC.
Zündungspunkt
250 ºF (121 ºC), geschlossener Tasse.
Wasserlöslichkeit
Praktisch unlöslich im Wasser.
0.022 mg/l Wasser bei 0 ºC
0044 mg/l Wasser bei 25ºC.
Ethanollöslichkeit
0,76 g/kg bei 16ºC
3,28 g/kg bei 25 ° C. Beachten Sie, wie löslicher in Ethanol ist als in Wasser bei der gleichen Temperatur.
Löslichkeit in Hexano
3,7 g/kg.
Löslichkeit in Benzol
16,3 g/l. Seine größte Löslichkeit in Benzol zeigt seine hohe Affinität zu ihm, da beide Substanzen aromatisch und zyklisch sind.
Kohlenstoffdisulfidlöslichkeit
32,25 g/l.
Dichte
1,24 g/cm3 bei 68 ºF (1,25 g/cm3 bei 23ºC).
Dampfdichte
6,15 (mit der Luft als Referenz entspricht 1).
Dampfdruck
1 mmHg bei 293 ºF (Sublima). 6,56 x 10-6 mmHg bei 25 ° C.
Stabilität
Es ist stabil, wenn es unter den empfohlenen Bedingungen gespeichert wird. Es ist Tribolumineszenz und Triboelektrikum; Dies bedeutet, dass es Licht und Elektrizität ausstrahlt, wenn es reibt. Anthracen verdunkelt sich, wenn es Sonnenlicht ausgesetzt ist.
Selbststeuerung
1.004 ºF (540 ºC).
Zersetzung
Es werden gefährliche Verbindungen durch Verbrennung (Kohlenoxide) erzeugt. Es zersetzt.
Es kann Ihnen dienen: Nitrobenzol (C6H5N2): Struktur, Eigenschaften, Verwendungen, RisikenVerbrennungswärme
40,110 kJ/kg.
Kalorienkapazität
210,5 j/mol · k.
Maximale Absorptionswellenlänge (sichtbares Licht und Ultraviolett)
Maximal λ 345,6 nm und 363,2 nm.
Schmiere
-0,602 CPOISE (240 ºC)
-0,498 CPOISE (270 ºC)
-0,429 CPOISE (300 ° C)
Wie zu sehen ist, nimmt seine Viskosität mit zunehmender Temperatur ab.
Nomenklatur
Anthracen ist ein einheitliches polyzyklisches Molekül, und nach der für diese Art von System festgelegten Nomenklatur sollte sein realer Name Tricen sein. Das TRI -Präfix ist auf die Tatsache zurückzuführen, dass es drei Messelringe gibt. Der triviale Name Anthracen hat sich jedoch in der populären und wissenschaftlichen Kultur erweitert und verwurzelt.
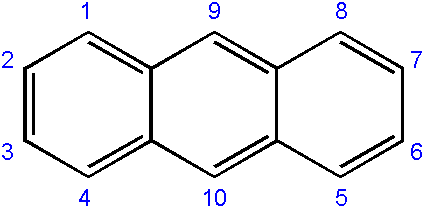
Die Nomenklatur der daraus abgeleiteten Verbindungen ist normalerweise etwas komplex und hängt vom Kohlenstoff ab, an dem ein Austausch erfolgt. Das Folgende zeigt die jeweilige Nummerierung von Kohlenstoffen für Anthract:
 Nummerierung von Karbons in Anthracen. Quelle: Edgar181 [Public Domain]
Nummerierung von Karbons in Anthracen. Quelle: Edgar181 [Public Domain] Die Nummerierungsreihenfolge ist auf die Priorität bei der Reaktivität oder Anfälligkeit der Kohlenstoffe zurückzuführen.
Die Kohlenstoffe der Enden (1-4 und 8-5) sind die reaktivsten, während die in der Mitte (9-10) durch andere Bedingungen reagieren; Zum Beispiel oxidativ, um das Antraquinon zu bilden (9, 10-Dioxontracen).
Toxizität
In Kontakt mit der Haut kann es Reizungen, Juckreiz und Brennen verursachen, was sich mit Sonnenlicht verschlechtert. Anthracen ist Photosensibilisator, der die durch UV -Strahlung verursachten Hautschäden verbessert. Es kann eine akute Dermatitis, eine Teangiektasie und eine Allergie verursachen.
In Kontakt mit den Augen kann es Reizungen verursachen und brennen. Atemanthracen kann Nase, Hals und Lungen reizen, Husten und Keuchen verursachen.
Anthracenaufnahme wurde beim Menschen mit Kopfschmerzen, Übelkeit, Appetitverlust, Entzündung des Magen -Darm -Trakts, langsamen Reaktionen und Schwäche in Verbindung gebracht.
Es gab Vorschläge für eine Krebswirkung von Anthracen. Diese Vermutung wurde jedoch nicht bestätigt, einschließlich einiger Anthraken -Derivate wurden bei der Behandlung bestimmter Krebsarten verwendet.
Anwendungen
Technologisch
-Anthracen ist ein organischer Halbleiter, der als Spinder in hohen Energiephotonen, Elektronen und Alpha -Partikeln verwendet wird.
-Es wird auch zur Plastikbeschichtung verwendet, wie z. B. Polyviniltoluol. Dies, um Plastikspindler mit wasserähnlichen Eigenschaften zu produzieren, um sie in der Strahlentherapie -Dosimetrie zu verwenden.
Es kann Ihnen dienen: Piperidin: Struktur, Synthese, Derivate, Reaktionen-Anthracen wird üblich. Dies ermöglicht die Überprüfung der Auskleidung mit ultraviolettem Licht.
Standalmolekül
Im Jahr 2005 synthetisierten die Chemiker der University of California, Riverside, das erste Standardmolekül: 9.10-ditioantraton. Dies wird in einer geraden Linie gedrückt, wenn es auf einer flachen Kupferoberfläche erhitzt wird, und kann sich bewegen, als hätte es zwei Fuß.
Die Forscher waren der Ansicht, dass das Molekül im molekularen Computing möglicherweise verwendet werden kann.
Piezokromatizität
Einige Anthracen -Derivate haben piezochromatische Eigenschaften, dh sie können die Farbe abhängig von dem angewendeten Druck ändern. Daher können sie als Druckdetektoren verwendet werden.
Anthracen wird auch zur Ausarbeitung der sogenannten Rauchbildschirme verwendet.
Ökologisch
Politische aromatische Kohlenwasserstoffe (PAH) sind Umweltschadstoffe, hauptsächlich aus Wasser. Daher werden Anstrengungen unternommen, um das toxische Vorhandensein dieser Verbindungen zu verringern.
Anthracen ist ein Material (PAH) und wird als Modell verwendet, um die Anwendung der Wasserpyrolyseverfahren beim Abbau von PAK -Verbindungen zu untersuchen.
Wasserpyrolyse wird in der industriellen Wasserbehandlung verwendet. Seine Wirkung auf das Anthracen erzeugte die Bildung von Oxidationsverbindungen: Antrron.
Diese Produkte sind weniger stabil als Anthracen und daher in der Umwelt weniger anhaltend, was leichter beseitigt werden kann als PAH -Verbindungen.
Andere
-Das Anthracen oxidiert so
-Anthracen wird im Holzschutz verwendet. Es wird auch als Insektizid, Schlaganfall, Herbizid und Ratikum verwendet.
-Anthracyclin -Antibiotika wurde in der Chemotherapie eingesetzt, da es die Synthese von DNA und RNA hemmt. Das Anthracyclin -Molekül wird zwischen den DNA/RNA -Basen zwischenstrichen und die Replikation schnell wachsender Krebszellen hemmt.
Verweise
- Anthracen. Abgerufen von: in.Wikipedia.Org
- Anthracen. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung

