Natrium Azida (NAN3) Struktur, Eigenschaften, Verwendungsmöglichkeiten, Risiken

- 4702
- 558
- Tizian Liebich
Der Natriumazid Es ist ein kristalliner anorganischer Feststoff, der durch das Natriumion Na gebildet wird+ Und die Azida nion3-. Seine chemische Formel ist Nan3. Die Nanverbindung3 Es ist das Natriumsalz von HN Hydrazonsäure3. Die Nan3 Es ist ein kristalliner farbloser Feststoff zu Weiß.
Obwohl es sich um eine sehr giftige Verbindung handelt, war eine der am weitesten verbreiteten Arbeitsplätze in den Airbags, die sofort bei Fahrzeugunfällen infiziert sind. Es dient auch dazu, die Notfallfolien des Flugzeugs schnell aufzublasen. Derzeit wird seine Verwendung in beiden Fällen jedoch für seine Toxizität sehr in Frage gestellt.
 Natriumnan Azid3 solide. И.С. Неноконов [CC By-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons.
Natriumnan Azid3 solide. И.С. Неноконов [CC By-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons. Es wird in chemischen Forschungslabors verwendet.
In einigen Labors wird es verwendet, um Materialien oder Geräte zu sterilisieren, aber bestimmte Arten von Mikroorganismen widerstehen ihrer bioziden Wirkung.
Es wurde auch in der Landwirtschaft verwendet, um Bodenparasiten oder in der Holzindustrie zu beseitigen, um zu verhindern, dass Kiefernholz mit Pilzen färbt.
[TOC]
Struktur
Das Natrium Azida Nan3 Es wird durch ein Natrium -na -Kation gebildet+ und ein Azidanion n3-.
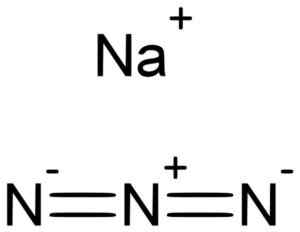 Natrium Azida wird durch das Natrium na gebildet+ Und die Azida nion3-. Lukáš Mižoch [Public Domain]. Quelle: Wikimedia Commons.
Natrium Azida wird durch das Natrium na gebildet+ Und die Azida nion3-. Lukáš Mižoch [Public Domain]. Quelle: Wikimedia Commons. Die Azida nion3- Es besteht aus 3 Stickstoffatomen (n), die durch kovalente Bindungen, die einfach, doppelt oder dreifach voneinander vereint sind.
Dieses Anion hat eine lineare Struktur, dh die drei Stickstoffatome, die in einer geraden Linie angeordnet sind. Zusätzlich ist die Struktur symmetrisch.
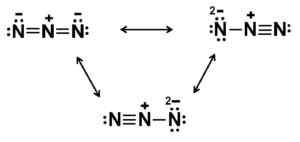 Mögliche Lewis -Strukturen von Azida Anion. Autor: Marilú Stea.
Mögliche Lewis -Strukturen von Azida Anion. Autor: Marilú Stea. Nomenklatur
- Natriumazid
- Natrium Azida
Eigenschaften
Körperlicher Status
Kristalline Feste farblos zu Weiß. Sechskantkristalle.
Molekulargewicht
65,01 g/mol
Schmelzpunkt
Es zersetzt sich bei 275 ° C.
Dichte
1,846 g/cm3 bei 20 ºC
Löslichkeit
Es ist sehr löslich in Wasser: 41,7 g/100 ml bei 17 ºC. Es ist in Ethanol leicht löslich und in Ethylether unlöslich.
Dissoziationskonstanten
Es hat eine PKB 9.3. Wässrige Lösungen enthalten NH3, was schnell aus der Umgebung mit 37 ºC entgeht.
Chemische Eigenschaften
Die Nan3 Es ist sehr ätzend gegenüber Aluminium und mäßig gegenüber Kupfer und Blei.
Kann Ihnen dienen: StickstoffvalencesLaut einer bestimmten Quelle, die konsultiert wurde, ist Natrium Azid nicht explosiv. Es zersetzt sich sanft und vollständig, wenn es bei 300 ° C oder mehr erhitzt wird und Natriummetall und Stickstoffgas n bildet2.
2 Nan3 → 2 Na + 3 n2↑
Es ist ein Nitriationsmittel, das bedeutet, dass es Stickstoff dient oder Stickstoff zu anderen chemischen Verbindungen oder der Oberfläche von Materialien wie Stahl hinzufügt.
Es ist stabil in neutralem oder alkalischem Wasser in Abwesenheit von Licht. Es zersetzt sich durch Sonnenstrahlung.
Biochemische Eigenschaften
Natriumazid hemmt ein Enzym namens Cytochromoxidase, das in den Mitochondrien von Zellen vorkommt und signifikant an der Atmung und der Energieerzeugung beteiligt ist.
Seine Wirkung verhindert die ATP -Erzeugung aus einer Schlüsselverbindung in Zellaktivitäten, und die Zell verschlechtert sich oder Schäden.
Wenn es aufgenommen, inhaliert oder mit dem Natriumazid in Kontakt ist, ist es sehr giftig und kann tödlich werden.
Erhalten
NH -Ammoniak reagiert3 Mit Metall Sodio na bei 350 ° C in einem geschlossenen Stahlbehälter, der Amid aus Natriumnanh erhält2.
Natriumnanh2 Es reagiert mit Dyitrogenmonoxid n2Oder bei 230 ° C in einem Nickelreaktor, und somit wird eine Mischung aus Natriumnan gebildet3, Natriumhydroxid NaOH und Ammoniak NH3.
2 Nanh2 + N2O → Nan3 + NaOH + NH3
Es kann auch erhalten werden, indem Natriumamid mit Nano -Natriumnitrat reagiert wird3 bei 175 ºC:
3 Nanh2 + Älterer Bruder3 → Nan3 + 3 NaOH + NH3
Um das Azid zu reinigen, wird dem Gemisch Wasser zugesetzt, die Kristalle der Azid werden gewaschen und dann verdampft das Wasser. Das kristalline Material, das verbleibt, ist die Azid von Natriumnan3 Das trocknet dann bei 110 ° C.
Anwendungen
In Kraftfahrzeugen und Flugzeugen
Natriumazid wurde in der Autoindustrie als Stickstoffgenerator häufig verwendet, um schnell Airbags aufzublasen (Englisch Airbags) Sicherheit von Autoflyern und Lastwagen, wenn ein Aufprall auftritt.
Es wurde auch in aufblasbaren Folien verwendet, die dazu dienen, schnell aus dem Inneren der Ebenen zu entkommen, die in Notsituationen gelandet sind.
In beiden Fällen beinhaltet der Mechanismus die Wirkung eines Funken2 und Natriumoxid na2ENTWEDER.
Kann Ihnen dienen: Doppel -Substitution -ReaktionDiese Anwendung erfordert eine sofortige Freisetzung eines kalten und nicht-technischen Gases, sodass Stickstoff das am besten geeignete Gas ist.
 Sicherheitsbeutel, die bereits in Fahrzeugen eingesetzt wurden. Autor: Marcel Langthim. Quelle: Pixabay.
Sicherheitsbeutel, die bereits in Fahrzeugen eingesetzt wurden. Autor: Marcel Langthim. Quelle: Pixabay. Diese Verwendung nimmt jedoch aufgrund der Toxizität von Natriumazid ab und wird stattdessen weniger giftige Verbindungen verwendet.
In der chemischen Industrie
Es wird als Verzögerer in der Gummiherstellung für Schwämme verwendet, um die Koagulation von Stretch- oder Butadien -Latex zu verhindern, wenn sie in Kontakt mit Metallen gelagert werden, und um Nitriten in Gegenwart von Nitraten zu zersetzen.
In der Landwirtschaft
Es wurde in der Landwirtschaft verwendet: Als biozidal und begasend ist es auch Nematik, dh es wird in Böden angewendet, um Nematoden zu beseitigen, die Parasiten sind, die einige Pflanzen angreifen.
 Schäden durch Nematoden an der Wurzel einer Pflanze. Autor: Redwolf. [http: // www.Ars-Grin.Gov/ARS/Soatlantic/FP/STPP/Burelle/Burelle.HTML] Quelle: Wikimedia Commons.
Schäden durch Nematoden an der Wurzel einer Pflanze. Autor: Redwolf. [http: // www.Ars-Grin.Gov/ARS/Soatlantic/FP/STPP/Burelle/Burelle.HTML] Quelle: Wikimedia Commons. Es hat auch als Herbizid und um verrottende Früchte zu vermeiden.
Kürzlich Nan3 Es wurde bei der Herstellung von Okra- oder Quimbombó -Samen verwendet, um seine Beständigkeit gegen Wasserwaterlogging -Bedingungen zu beobachten.
Die Samen, auf die Nan zuvor angewendet wurde3 Sie erzeugten Sämlinge, die die Flutbedingungen besser zurückgezogen haben als die unvernünftigen, verbesserten die Höhe der Pflanzen, erhöhten die Anzahl der Blätter und erhöhten die Wurzelmenge selbst mit dem Wasserüberschuss.
Bei der Herstellung anderer chemischer Verbindungen
Es wird als chemisches Reagenz in der Synthese organischer Verbindungen verwendet, um beispielsweise viele organische Azide herzustellen, wie z.
Es dient zur Herstellung von Hydrazonsäure (HN3) und reines Natrium (Na).
In der Sprengstoffindustrie
Das Natrium Azida Nan3 Es ist ein Vermittler in der explosiven Fertigung, da es für die Herstellung von Blei Azid verwendet wird3)2. Letzteres ist eine Verbindung, die bei starkem geschlagenem Explosion explodiert, daher wird sie beim Aufbau von Detoniergeräten verwendet.
 Das Natrium Azida Nan3 Es wird zur Herstellung des PB -Bleis (n) verwendet3)2 Verbindungen, die Teil von Geräten sind, um Explosionen zu erzeugen. Autor: OpenClipart-Vektoren. Quelle: Pixabay.
Das Natrium Azida Nan3 Es wird zur Herstellung des PB -Bleis (n) verwendet3)2 Verbindungen, die Teil von Geräten sind, um Explosionen zu erzeugen. Autor: OpenClipart-Vektoren. Quelle: Pixabay. In biochemischen Labors
Natriumazid wird verwendet, wenn sterile Laborgeräte erforderlich sind, da sie verschiedene Arten von Mikroorganismen zerstören können.
Es kann Ihnen dienen: Hypophysensäure (H3PO2): Eigenschaften, Verwendung und ReagenzienEs ist ein Biozidagent. Einige Quellen zeigen jedoch, dass einige Arten von Bakterien gegen ihre Wirkung resistent sind.
Dies wird erreicht, indem die Sauerstoffbindungsstelle im Oxidase -Cytochrom blockiert wird, das ein Enzym ist, der am Energieproduktionsprozess einiger Mikroorganismen beteiligt ist.
Es wird in automatischen Blutzähler verwendet, auch in der unterschiedlichen Selektion von Bakterien und zur Erhaltung von Laborreagenzentenlösungen, da es das Wachstum bestimmter Mikroorganismen in diesen verhindert.
In mehreren Verwendungen
Natrium Azida dient in der Holzindustrie, um das Wachstum brauner Pilzflecken auf Kiefernholz zu vermeiden.
Es wurde auch in der japanischen Bierindustrie eingesetzt, um die Entwicklung eines Pilzes zu vermeiden, der das Trinken verdunkelt.
Risiken
Natriumazid ist eine toxische Verbindung, die ein wichtiges Enzym für das Atmen und das Leben von Menschen- und Tierenzellen hemmt. Es wurde festgestellt, dass es die Zellgewebezellen des Gehirnblutgefäßes ernsthaft beeinflussen kann.
Seine unmittelbare Wirkung nach Einnahme, Inhalation oder Hautkontakt besteht darin, den Blutdruck gefährlich zu senken, was zum Tod führen kann. Daher muss es mit großer Vorsicht manipuliert werden.
Es gibt Informationsquellen, die die Aufmerksamkeit auf die Airbags von Fahrzeugen erregen, die aus Abfallgründen zerstört werden.
In solchen Fällen können Personen, die nicht wissen, dass die Gefahr auf NAN -Einlagen zugreifen kann3, Dies ist eine sehr giftige Verbindung. Darüber hinaus besteht die Gefahr der Kontamination mit Nan3 Boden und Wasser.
Ebenso könnten Menschen bei Unfällen, Kollisionen oder Fahrzeugbränden Menschen NAN ausgesetzt sein3 Und dies kann von dem medizinischen Personal unterschätzt oder unbekannt, um den Notfall zu besuchen.
Aufmerksamkeit auf die Ausstellung des Laborpersonals, das sie benutzt.
Verweise
- Vwioko, e.D. et al. (2019). Das Natriumazid -Priming verbessert die Wasserlogging -Stress -Toleranz in Okra (Abelmoschus Esculentus). Agronomie 2019, 9, 670. MDPI erholt sich.com.
- Kho, d.T. et al. (2017). Tod der Bluthirnbarriere -Endothelzellen zu Natriumazid und seinen gasförmigen Produkten. Biosensors 2017, 7, 41. MDPI erholt sich.com.
- ODER.S. Nationalbibliothek für Medizin. (2019). Natriumazid. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung.
- Talavera, m. et al. (2019). Nematodenmanagement in den Erdbeerfeldern Südspaniens. Agronomie 2019, 9, 252. MDPI erholt sich.com.
- Okano, t. et al. (1995). Mechanismus der Zellablösung von temperaturmodulierten, hydrophilen Hydrophoben Polymeroberflächen. In den Biomaterialien: Silber -Jubiläumskompendium. Von Scientedirect erholt.com.
- Ullmanns Enzyklopädie der industriellen Chemie. (1990). FÜNFTE AUSGABE. Band A22. VCH Verlagsgellschaft MBH.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Chang, s. und Lamm, s.H. (2003). Auswirkungen der menschlichen Gesundheit von Natriumazid -Exposition: Eine Literaturübersicht und -analyse. Int J Toxicol 2003, 22 (3): 175-86. NCBI erholte sich.NLM.NIH.Regierung.
- « Alles Gute zum Geburtstag die besten Sätze, um sich zu widmen
- 105 Phrasen für untreue Männer und Frauen »

