Schwefelgeschichte, Eigenschaften, Struktur, erhalten, verwendet, verwendet

- 3156
- 148
- Lewis Holzner
Er Schwefel Es handelt. Es befindet sich speziell in Gruppe 16 mit Periode 3 und wird mit dem chemischen Symbol s dargestellt. Seiner natürlichen Isotope die 32S schläft viel (etwa 94% aller Schwefelatome).
Es ist eines der am häufigsten vorkommenden Elemente der Erde, das ungefähr 3% seiner Gesamtmasse besteht. Das heißt, wenn der gesamte Schwefel des Planeten genommen wurde, konnten zwei gelbe Monde gebaut werden; Es würde drei Satelliten statt eines geben. Es kann mehrere Oxidationszustände (+2, -2, +4 und +6) annehmen, sodass ihre Salze zahlreich sind und den terrestrischen Kortex und den Kern anreichern.
 Schwefelkristalle. Quelle: Pixabay.
Schwefelkristalle. Quelle: Pixabay. Schwefel ist ein Synonym für gelbe, schlechte Gerüche und Hölle. Der Hauptgrund für seine schlechten Gerüche ist die abgeleiteten Verbindungen; Besonders gasförmig und organisch. Von den anderen sind ihre Mineralien solide und haben Farben, die unter anderem gelb, grau, schwarz und weiß gehören.
Es ist eines der Elemente, die die meisten eine große Anzahl von Alotropen präsentieren. Es kann als kleine und diskrete Moleküle von S gefunden werden2 oder s3; als Ringe oder Zyklen, ortorrombisch und monokliner Schwefel sein8 das stabilste und reichlichste von allen; Und als helikale Ketten.
Es ist nicht nur im Landrinx in Form von Mineralien vorhanden, sondern auch in den biologischen Matrizen unseres Körpers. Zum Beispiel ist es in Cystin-, Cystein- und Methionin -Aminosäuren in Eisen, Keratin und Vitaminenproteinen. Es ist auch in Knoblauch, Grapefruits, Zwiebeln, Kohl, Brokkoli und Blumenstücken vorhanden.
Chemisch ist es ein weiches Element, und in Abwesenheit von Sauerstoff bilden Schwefelmineralien und Sulfate. Verbrennt mit einer bläulichen Flamme und kann als amorpher oder kristalliner Feststoff gezeigt werden.
Obwohl es für die Synthese von Schwefelsäure, sehr ätzender Substanz und der Gewährung unangenehmer Gerüche unverzichtbar ist, ist es tatsächlich ein gutartiges Element. Schwefel kann ohne große Vorsichtsmaßnahmen in jedem Raum gespeichert werden, solange Brände vermieden werden.
[TOC]
Geschichte des Schwefels
In der Bibel
Schwefel ist eines der ältesten Elemente in der Geschichte der Menschheit; So sehr, dass seine Entdeckung ungewiss ist und nicht bekannt ist, welches der alten Zivilisationen sie zum ersten Mal verwendet hat (4000 Jahre vor Christus). Auf denselben Seiten der Bibel können Sie das Infernalfeuer und die Zusammenbrüche begleiten.
Es wird angenommen, dass der angebliche Geruch der Hölle mit Vulkanausbrüchen zu tun hat. Sein erster Entdecker musste sicherlich in Minen dieses Elements als Staubländer oder gelbe Kristalle in der Nähe eines Vulkans geraten.
Antike
Dieser gelbliche Feststoff zeigte bald bemerkenswerte Heilungseffekte. Zum Beispiel verwendeten die Ägypter Schwefel, um die Entzündungen der Augenlider zu behandeln. Es entlastete auch Krätze und Akne, eine Anwendung, die heute in Schwefelseifen und anderen dermatologischen Gegenständen zu sehen ist.
Die Römer verwendeten dieses Element in ihren Ritualen wie Fumigante und Bleichmittel. Wenn Librara sos2, Gas, das die Räume überflutete, die mit Feuchtigkeit mischen und ein antibakterielles Medium liefern und Insekten vernichten können.
Die Römer entdeckten, wie die Griechen. Die Farbe seiner bläulichen Flammen musste die römischen Zirkusse beleuchten. Es wird angenommen, dass die Griechen dieses Element inzwischen benutzten, um Brandwaffen zu schaffen.
Die Chinesen auf ihrer Seite erfuhren, dass das Mischen von Schwefel mit Salpeter (KNO3) und Kohle schuf den schwarzen Schießpulver, der einen historischen Umsatz bezahlte und die in den Nationen damals großer Anforderungen und Interesse an diesem Mineral erregt hat.
Es kann Ihnen dienen: Circonium: Geschichte, Eigenschaften, Struktur, Risiken, verwendetModerne Zeiten
Als ob Schießpulver kein ausreichender Grund für die begehrten Schwefel wäre, tauchten bald Schwefelsäure und industrielle Anwendungen auf. Und mit dem Schwefelsäureband.
Erst 1789, als der brillante Chemiker Antoine Lavoizier Schwefel erkennen und als Element klassifizieren konnte. 1823 entdeckte der deutsche Chemiker Eilhard Mitscherlich, dass Schwefel überwiegend auf zwei Arten kristallisieren kann: Rhomboédrica und monoklinisch.
Die Schwefelgeschichte folgte dem gleichen Kanal seiner Verbindungen und Anwendungen. Mit der enormen industriellen Bedeutung von Schwefelsäure begleitete er die Vulkanisierung von Gummi, die Synthese von Penicillin, die Ausbeutung von Bergbau, die Verfeinerung von schwefelreichen Ölrouhen, Bodenernährung usw.
Eigenschaften
Aussehen
Brise fest in Staub oder Kristallen. Seine Farbe ist undurchsichtig, zitronengelb, sie ist geschmacklos und es gibt keinen Geruch.
Flüssiges Aussehen
Flüssiger Schwefel ist einzigartig, weil seine anfängliche gelbe Farbe rötlich wird und sich intensiviert und verdunkelt, wenn sie hohe Temperaturen durchläuft. Wenn es brennt, sagen Sie blaue und helle Flammen.
Molmasse
32 g/mol.
Schmelzpunkt
115.21ºC.
Siedepunkt
445ºC.
Zündungspunkt
160ºC.
Self -Anmut -Temperatur
232ºC.
Dichte
2,1 g/ml. Andere Alotrope können jedoch weniger dicht sein.
Molarenwärmekapazität
22.75 j/mol · k
Radio kovalent
105 ± 3 Uhr.
Elektronegativität
2,58 auf der Paulingskala.
Polarität
S-S-Verbindungen sind apolar, da beide Schwefelatome die gleiche Elektronegativität aufweisen. Dies macht alle seine Alotrope, zyklisch oder in Form von Ketten, apolar; Und daher sind seine Wechselwirkungen mit Wasser ineffizient und können darin nicht solubilisiert werden.
Schwefel kann jedoch in apolaren Lösungsmitteln wie Carbon Disulfid, CS gelöst werden2, und aromatisch (Benzol, Toluol, Xylol usw.).
Ionen
Schwefel kann mehrere Ionen bilden, im Allgemeinen Anionen. Das Beste bekannt ist Sulfid, s2-. Die s2- Es zeichnet sich durch sperrig und eine weiche Basis von Lewis aus.
Um eine weiche Basis zu sein, legt die Theorie fest, dass sie dazu neigen, Verbindungen mit weichen Säuren zu bilden; Wie Übergangsmetallkationen, einschließlich des Glaubens2+, Pb2+ und cu2+.
Elektronische Struktur und Konfiguration
Die Schwefelkrone
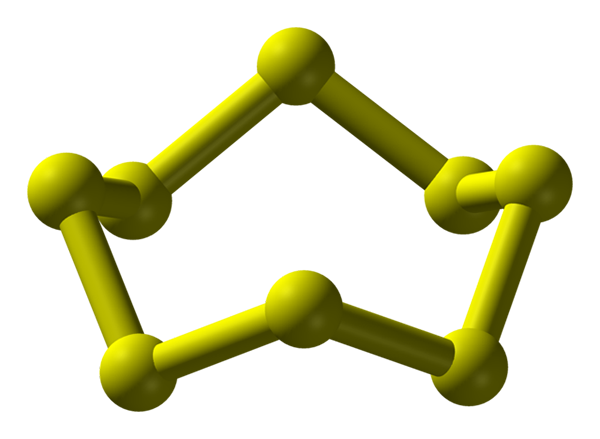 S8 -Molekül, das stabilste und reichlichste alotrope Schwefel. Quelle: Benjah-BMM27.
S8 -Molekül, das stabilste und reichlichste alotrope Schwefel. Quelle: Benjah-BMM27. Schwefel kann in einer Vielzahl von Alotropen auftreten; und diese wiederum haben kristalline Strukturen, die unter unterschiedlichen Drücken und/oder Temperaturen modifiziert sind. Daher ist Schwefel ein reichhaltiges Element in Alotropos und Polymorphen, und die Untersuchung seiner festen Strukturen stellt eine endlose Quelle theoretischer experimenteller Werke dar.
Warum eine solche strukturelle Komplexität? Zunächst sind kovalente Bindungen im Schwefel (S-S) sehr stark und werden nur durch Kohlenstoff, C-C und durch Wasserstoff H-H überwunden.
Schwefel neigt im Gegensatz zu Kohlenstoff nicht dazu, Tetraeder, sondern Boomerangs zu bilden; Das mit ihren Winkeln falten sie und klingeln, um Schwefelketten zu stabilisieren. Der bekannteste Ring von allen, der auch den stabilsten Alotrop von Schwefel darstellt, ist der S8, Die "Schwefelkrone" (höheres Bild).
Beachten Sie, dass alle S-S-Links8 Sie scheinen einzelne Boomerangs zu sein, was zu einem Ring mit Falten und überhaupt flach führt. Diese Kronen s8 Sie interagieren durch Londoner Kräfte, die so ausgerichtet sind, dass sie es schaffen, strukturelle Muster zu erzeugen, die einen ortorrombischen Kristall definieren. genannt s8 α (S-α oder einfach ortorrombischem Schwefel).
Kann Ihnen dienen: elastische MaterialienPolymorphen
Die Schwefelkrone ist eines der vielen Alotrope für dieses Element. Die s8 α ist ein Polymorph dieser Krone. Es gibt zwei weitere (unter den wichtigsten) als S genannt8 β und s8 γ (S-β bzw. S-γ). Beide Polymorphen kristallisieren in monoklinen Strukturen und sind die S8 γ ist dichter (Schwefel Gamma).
Die drei sind gelbe Feststoffe. Aber wie wird jedes Polymorph getrennt erhalten??
Die s8 β stellt die s vor8 α bei 93 ° C und ermöglicht dann, dass seine langsame Kühlung seinen Rückgabergang in die ortorrombische Phase verlangsamt (das α). Und die s8 γ dagegen wird erhalten, wenn es basiert8 α bei 150 ° C, was wieder langsam abkühlen lässt; Es ist der dichteste der Schwefelkronenpolymorphen.
Andere zyklische Alotrope
Die Krone s8 Es ist nicht das einzige zyklische Alotrope. Es gibt andere wie s4, S5 (Analog zu Cyclopentano), s6 (dargestellt durch ein Sechseck sowie durch den Zyklus), s7, S9, und s10-20; Letzteres bedeutet, dass es Ringe oder Zyklen geben kann, die zehn bis zwanzig Schwefelatome enthalten.
Jeder von ihnen repräsentiert unterschiedliche zyklische Schwefelvoluma; Und um es zu betonen, haben sie Sorten von Polymorphen oder polymorphen Strukturen, die von Druck und Temperatur abhängen.
Zum Beispiel die s s7 Es hat bis zu vier bekannte Polymorphs: α, β, γ und δ. Die Mitglieder oder Kronen höherer Molekularmassen sind organische Syntheseprodukte und dominieren nicht in der Natur.
Schwefelketten
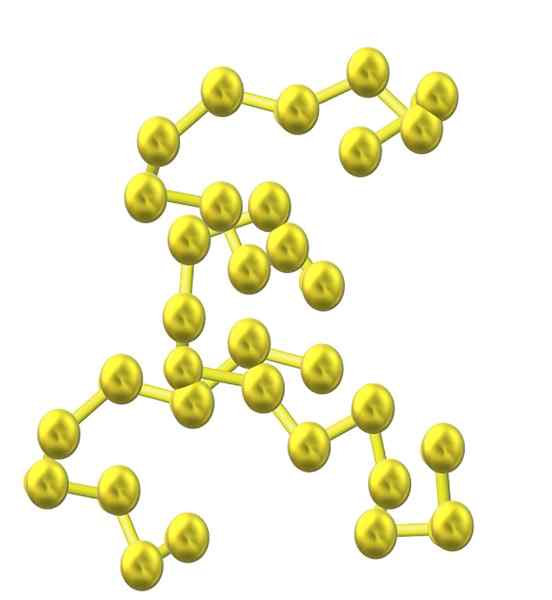 Schwefelkette. Quelle: Opentax [CC von 4.0 (https: // creativecommons.Org/lizenzen/bis/4.0)]]
Schwefelkette. Quelle: Opentax [CC von 4.0 (https: // creativecommons.Org/lizenzen/bis/4.0)]] Da mehr Schwefelatome in die Struktur eingebaut sind, nimmt ihre Tendenz zum Ring ab und Schwefelketten bleiben offen und nehmen helikale Konformationen an (als wären sie Spiralen oder Schrauben).
Und somit entsteht eine andere voluminöse Familie von Schwefel -Alotrops, die nicht aus Ringen oder Zyklen, sondern aus Ketten (wie dem überlegenen Bild) besteht.
Wenn diese S-S-Ketten parallel zum Glas ausgerichtet sind, fangen sie Unreinheiten auf und definieren am Ende einen faserigen Feststoff, der als faseriger Schwefel oder S-ψ bezeichnet wird. Wenn es unter diesen parallelen Ketten kovalente Bindungen gibt, die sie miteinander verbinden (wie bei der Vulkanisierung von Gummi), haben wir Laminar -Schwefel.
Wenn Schwefel s8 Es schmilzt eine gelbliche flüssige Phase, die dunkel werden kann, wenn die Temperatur erhöht wird. Dies liegt daran, dass S-S-Links gebrochen sind und daher ein thermischer Depolymerisationsprozess auftritt.
Diese Flüssigkeit, wenn Kühlungen plastische Eigenschaften zeigen und dann glasig; Das heißt. Seine Zusammensetzung besteht sowohl aus Ringen als auch aus Schwefelketten.
Und wenn eine Mischung aus faserigem und laminarem Alotrop aus dem amorphen Schwefel erhalten wird, ein kommerzielles Produkt zur Vulkanisierung von Gummi verwendet.
Kleine Alotrope
Obwohl sie zuletzt übrig bleiben, sind sie nicht weniger wichtig (oder interessant) als die Alotropos der größten Molekülmassen. S2 und s3 sind die sulfurisierten Versionen des O2 ICH3. In den ersten beiden Schwefelatomen verbinden sie eine Doppelbindung, S = S, und in der zweiten gibt es drei Atome mit Resonanzstrukturen, S = S-S.
Beide s2 wie die s3 Sie sind gasförmig. Die s3 Manifestieren eine kirschrote Färbung. Die beiden haben genug bibliografisches Material für jeden Abdeckung eines einzelnen Artikel.
Elektronische Konfiguration
Die elektronische Konfiguration für das Schwefelatom lautet:
[Ne] 3s2 3p4
Sie können zwei Elektronen verdienen, um Ihr Octeto von Valencia zu vervollständigen, und somit einen Oxidationszustand von -2 haben. Ebenso können Sie Elektronen verlieren, beginnend mit zwei in den 3p -Orbitalen, der seinen Oxidationszustand von +2 ist. Wenn Sie zwei weitere Elektronen mit Ihren leeren 3p -Orbitalen verlieren, beträgt Ihr Oxidationsstatus +4; Und wenn Sie alle Elektronen verlieren, wird es +6 sein.
Kann Ihnen dienen: MetalloidenErhalten, wo ist Schwefel?
Mineralogisch
Schwefel ist Teil vieler Mineralien. Unter ihnen sind der Pyrit (fes2La Galena (PBS), Covellita (CUS) und andere Sulfat- und Sulfide Mineralien. Durch die Verarbeitung können nicht nur Metalle extrahiert werden, sondern auch Schwefel nach einer Reihe reduktiver Reaktionen.
Es kann auch nur in vulkanischen Lüftungsschlitzen erhalten werden, wo die Temperatur erhöht und bergab verfällt; Und wenn er in Brand setzt, wird er wie eine bläuliche Lava aussehen. Durch mühsame Arbeit und anstrengende physikalische Werke kann Schwefel gesammelt werden, da dies in Sizilien ziemlich häufig durchgeführt wurde.
Schwefel kann auch in unterirdischen Minen gefunden werden, die zum Pumpen von Überhitzung von Wasser zum Schmelzen und Übertragung an die Oberfläche vorhanden sind. Dieser Erhaltsprozess wird als Brasch -Prozess bezeichnet, der derzeit wenig verwendet wird.
Petroleum
Heute stammt der größte Teil des Schwefels aus der Ölindustrie, da seine organischen Verbindungen Teil der Zusammensetzung des Ölrohöls und seiner raffinierten Derivate sind.
Wenn ein raffiniertes Rohöl oder ein Produkt reich an Schwefel ist und hydrodesulfurisiert wird, füllt es große Mengen von H frei2S (stinkendes Gas, das nach faulen Eier riecht):
R-S-R + 2 H2 → 2 rh + h2S
Dann h2S ist es chemisch im Clauss -Prozess, zusammengefasst mit den folgenden chemischen Gleichungen:
3 o2 + 2 h2S → 2 so2 + 2 h2ENTWEDER
SW2 + 2 h2S → 3 s + 2 h2ENTWEDER
Anwendungen
Einige der Verwendungen für Schwefel werden unten und im Allgemeinen erwähnt:
- Es ist ein wesentliches Element für Pflanzen und Tiere. Es ist sogar in zwei Aminosäuren vorhanden: Cystein und Methodein.
- Es ist der Rohstoff für Schwefelsäure, der in der Herstellung von unzähligen kommerziellen Produkten besteht.
- In der pharmazeutischen Industrie ist es für die Synthese von Schwefelderivaten bestimmt, wobei das Penicillin das bekannteste der Beispiele ist.
- Ermöglicht die Vulkanisierung von Gummi durch Zusammenhänge von Polymerketten mit S-S-Links.
- Seine gelbe Farbe und Gemische mit anderen Metallen machen es in der Pigmentindustrie wünschenswert.
- Gemischt mit einer anorganischen Matrix wie Sand und Steinen, Beton und Schwefel -Asphalt werden für den Ersatz des Bitumen hergestellt.
Risiken und Vorsichtsmaßnahmen
Schwefel allein ist eine harmlose, nicht -toxische Substanz und stellt auch mögliche Risiken dar, es sei denn. Die Sulfatsalze sind nicht gefährlich und können ohne große Vorsichtsmaßnahmen manipuliert werden. Dies geschieht jedoch nicht mit seinen gasförmigen Derivaten: so2 und h2S, beide extrem giftig.
Wenn es sich in einer flüssigen Phase befindet, kann es schwerwiegende Verbrennungen verursachen. Wenn Sie in großen Mengen verschlingen, kann H auslösen2S im Darm. Für den Rest stellt es kein Risiko für diejenigen dar, die kauen.
Im Allgemeinen ist Schwefel ein sicher.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Laura Crapanzano. (2006). Polymorphismus von Schwefel: Strukturelle und dynamische Aspekte. Physik [Physik].Universität Joseph -fourier - Grenoble i. Englisch. Fftel-00204149f
- Wikipedia. (2019). Allotrope von Schwefel. Abgerufen von: in.Wikipedia.Org
- Meyer schlug. (1976). Elementarschwefel. Chemische Bewertungen, vol. 76, nein. 3.
- DR. Doug Stewart. (2019). Schwefelelement -Fakten. Chemicool. Erholt von: Chemicoolool.com
- Donald w. Davis und Randall a. Detro. (2015). Schwefelgeschichte. Georgia Gulf Sulfur Corporation. Erholt von: Georgiagulfsulfur.com
- Helmestine, Anne Marie, ph.D. (11. Januar 2019). 10 interessante Schwefelfakten. Erholt von: thoughtco.com
- Boone, c.; Bond, c.; Hallman, a.; Jenkins, j. (2017). Allgemeines Schwefel -Faktenblatt; Nationales Pestizidinformationszentrum, Erweiterungsdienste der Oregon State University. Npic.Orst.Edu
- « Unabhängigkeit von Mexiko Ursachen, Entwicklung, Konsequenzen, Charaktere
- Flora und Fauna der repräsentativen Arten von Jalisco »

