Bromotimol blau

- 1230
- 56
- Timo Rabenstein
 Bromotimolblau ist ein pH -Indikator. Quelle: Wikimedia Commons
Bromotimolblau ist ein pH -Indikator. Quelle: Wikimedia Commons Was ist Bromotimolblau?
Er Bromotimol blau Es ist ein Derivat von Tifenylmetano, das als pH -Indikator dient. Ein Indikator ist ein organischer Farbstoff, dessen Farbe von der Konzentration der Ion H abhängt3ENTWEDER+ oder des mittleren pH. Aufgrund der Farbe, die sie aufweist, kann der Indikator die Säure oder Alkalität der Lösung anzeigen.
Bromotimolblau hat eine aktive Indikationsskala zwischen einem pH 6.0 und 7.6. Zu einem pH des Mediums weniger als 6.5 (Säure) manifestiert eine gelbe Färbung. Wenn der mittlere pH zwischen 6 variiert.5 und 7.6 (neutral), erwirbt eine grüne Färbung. Ein pH -Wert von mehr als 7.6 seine Farbe ist blau (einfach).
Diese Funktion verleiht ihm ein großartiges Nutzen, da es auf einer pH -Skala nahe der Neutralität verwendet werden kann, genau dort, wo physiologische Prozesse auftreten.
Bromotimolblau -Ionisation in wässriger Lösung kann wie folgt schematisiert werden:
Hin (gelb) +h₂o in- (blaue Farbe) + h3ENTWEDER+
Wenn der Indikator protoniert ist (Hin), erhält eine gelbe Färbung; Während der Indikator ungeschützt ist (in-) Färbung ist blau.
Chemische Struktur
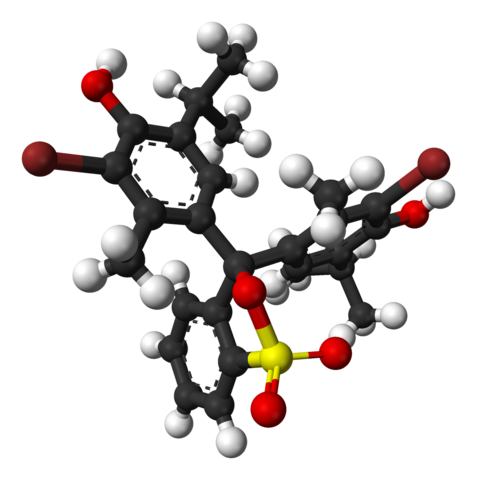 Chemische Struktur von Bromotimolblau. Quelle: Wikimedia Commons
Chemische Struktur von Bromotimolblau. Quelle: Wikimedia Commons Im oberen Bild wird die Struktur von Bromotimolblau mit einem Balkenmodell und Kugeln zu einem pH -Wert von weniger als 7 dargestellt.1. Braune Balken entsprechen Bromatomen, insgesamt zwei.
Jede der drei aromatischen Ringe bestehen neben den Methylgruppen, CH3, Und thermisch, die Timol -Gruppe und nachdem er einen BR verknüpft hat, wird der Grund als "Bromotimol" bezeichnet.
Kann Ihnen dienen: HydroxideIm unteren Teil wird die Sulfonatgruppe gezeigt, r-so3-, Mit roten Kugeln und einem Gelb. Diese Gruppe kann durch ein Atom oder ein zentrales Kohlenstoff mit den drei aromatischen Ringen verbunden werden.
PH ändert sich
Diese molekulare Struktur verändert zwar nicht radikal mit saurem oder basischem pH, verändert seine elektronischen Zustände, die sich durch Farbveränderungen von Lösungen widerspiegeln.
Unter dem pH 7 ist der Indikator gelb und nimmt die Struktur des Bildes an.
Infolgedessen ändert sich das konjugierte System des Moleküls (das aller doppelten Resonanzbindungen) genug, sodass die Elektronen nicht mehr die gleichen Photonen absorbieren und die Lösung von gelb bis blau wird.
Wenn andererseits der pH -Wert deutlich unter 7 liegt, ändert sich die Farbe des Indikators von gelb nach rot. Hier ist die Änderung des konjugierten Systems auf die Protonierung der Gruppen -oh a -oh zurückzuführen2+. -
Sowohl im sauren als auch im basischen Medium verliert das Molekül die Stabilität und absorbiert kleinere Photonen, um elektronische Übergänge für die von Zuschauern wahrgenommenen Farben verantwortlich zu ermöglichen.
Die im Hauptbild beobachtete grüne Farbe beruht auf Folgendes: Wenn der pH bei 7 nähert.1, ein kleiner Teil der Moleküle verliert Protonen und verabschiedet sich von einer blauen Farbe, die mit Gelb die grüne Farbe verleiht.
Eigenschaften dBromootimol Blue
Chemischer Name
Bromotimolblau oder 3,3'-Dibromotimolsulfonafet.
Molekularformel
C27H28Br2ENTWEDER5S.
Molekulargewicht
624.384 g/mol.
Aussehen
Festen Farbstaub zwischen Rosa und Lila.
Kann Ihnen dienen: Butanal: Struktur, Eigenschaften, Verwendung und RisikenChemisches Merkmal
Wirkt in Lösung als schwache Säure. Wenn es in einem sauren Medium protoniert wird, erwerbt es eine gelbe Farbe, ein neutraler pH -Wert ist grün, und wenn es in einem alkalischen pH -Wert unangenehm ist, ist es blau.
Ionische Dissoziationskonstante (KA)
7.9 x 10-8.
Aktiver Indikationsbereich
pH 6.0 bis 7.6. Dies ist auf das Vorhandensein von Bromatomen zurückzuführen, die durch Extrahieren von Elektronen und zwei mittelschwere Elektronendonorgruppen (Alkylsubstituenten) wirken.
Dichte
1.25 g/cm3.
Schmelzpunkt
202 ° C (396 ° F).
Siedepunkt
184.9 ° C.
Löslichkeit
Es ist kaum löslich in Wasser und Öl. Es ist auch in nichtpolaren Lösungsmitteln wie Benzol, Toluol und Xylol und praktisch unlöslich in Ölether löslich. Es ist löslich in wässrigen Lösungen von Alkalis und Alkohol.
Stabilität
Es ist stabil bei Umgebungstemperatur und mit starken Oxidationsmitteln inkompatibel.
Lichtabsorption
Die protonierte Form hat ihre maximale Absorption bei einer Wellenlänge (λ) von 427 nm, wodurch gelbes Licht in Säurelösungen übertragen wird, und die ungeschützte Form hat eine maximale Absorption bei einer Wellenlänge (λ) von 602 nm, überträgt ein Licht mit einem hellen Blau nach alkalischer pH.
Verwendung und Anwendungen
In Stoffwechselstudien
Bromotimolblau wird in zahlreichen Prozessen verwendet, bei denen Kohlendioxid (CO₂) mit der daraus resultierenden Erzeugung von Kohlensäure (H) erzeugt wird (H)2CO3), was das Medium sauer wird, das durch eine Änderung der Färbung von Bromotimolblau zeigt.
Wenn eine Person eine körperliche Übung durchführt und mit einem Röhrchen verbunden ist, das wiederum mit einem Behälter mit einer Lösung von Bromotimolblau steht, wird das folgende Phänomen beobachtet: Als Folge der Zunahme der körperlichen Aktivität und der Stoffwechsel wird eine Zunahme der CO₂ -Produktion auftreten.
Kann Ihnen dienen: Silizium: Geschichte, Eigenschaften, Struktur, Erhalten, VerwendungenDer CO₂ reagiert mit Wasser und erzeugt Kohlensäure, h2CO3, Das dissoziiert später die Ion H+ und das Medium ansäuern. Dies führt dazu, dass Bromotimolblau eine gelbe Färbung erfasst und die Säure der Umwelt hervorhebt.
In Geburtshilfe
Bromotimolblau wird in Geburtshilfe verwendet, um einen frühen Membranenbruch zu zeigen. Die Fruchtwasserflüssigkeit hat normalerweise einen pH -Wert von mehr als 7.7, also Bromotimolblau wird blau färben, wenn es mit der Flüssigkeit, die dem Amnio entkommt.
Der vaginale pH -Wert ist normalerweise sauer, also hat Bromotimolblau eine gelbe Färbung. Die Änderung seiner Farbe zu Blau zeigt das Vorhandensein von Fruchtwasser im Vaginalbereich.
Andere Verwendungen
Bromotimol Blue hat auch Anwendung in den folgenden Geräten und Funktionen:
- Optische Sensoren
- Erkennung von Gasverbrennungsanlagen
- In der Ausarbeitung von Gemälden, Spielzeug, Reinigungsprodukten, Reinigungsmitteln und Textilien
- Lebensmittelfrische Sensoren
- Als frischer Reiskennung und ranzig
- Bei der Erkennung von Mikroorganismen.
Es wird auch in der Bakterienwachstumsanalyse, psychoaktiven Medikamenten und Zahnmaterialien verwendet.
Vorbereitung
100 mg Bromotimolblau werden in 100 ml verdünntem Alkohol gelöst und filter. Es wird auch wie folgt hergestellt: 50 mg Bromotimolblau wird in einer Mischung aus 4 ml 0,02 n Natriumhydroxid und 20 ml Alkohol gelöst, wobei 100 ml mit Wasser mit Wasser mit Wasser abgeschlossen werden.
Verweise
- Fertigung l. Bromothymol Blue: Definition, Verwendung und Formel. Studie erholt sich.com
- Bromothymolblau -pH -Indikator, 1 oz. Von Sciencecompany geborgen.com
- Spektrophotometrische Bestimmung von PK des Bromothymolblau -Indikators. Von FCH geborgen.Upol.CZ

