Ausgleich von chemischen Gleichungen
- 3003
- 117
- Nick Laurén
Was ist das Ausgleich von chemischen Gleichungen?
Das Ausgleich chemischer Gleichungen ist eine mathematische Operation, die durchgeführt wird, um das Gesetz der Erhaltung der Materie bei Reaktionen aufrechtzuerhalten. Materie wird nicht erstellt oder zerstört. Daher muss die Anzahl der Atome vor und nach einer chemischen Reaktion gleich sein, sowohl in den Reagenzien als auch in den Produkten.
Um eine chemische Gleichung auszugleichen, müssen Sie die Atome vor und nach dem Pfeil zählen. Wenn die Zahlen übereinstimmen, bedeutet dies, dass die Reaktion ausgeglichen ist. Andernfalls ist es erforderlich, diese Zahlen zu entsprechen, indem die stöchiometrischen Koeffizienten durch Versuch und Irrtum geändert werden. Dies ist die einfachste und intuitivste Methode für das Gleichgewicht.
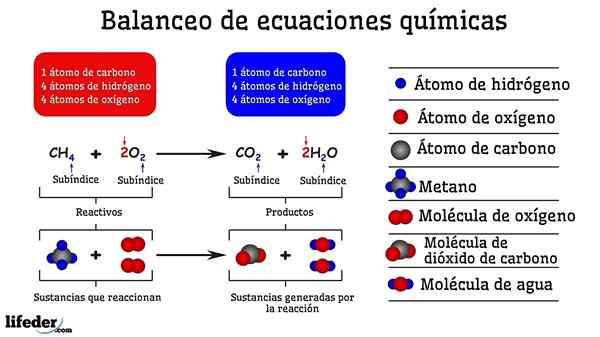
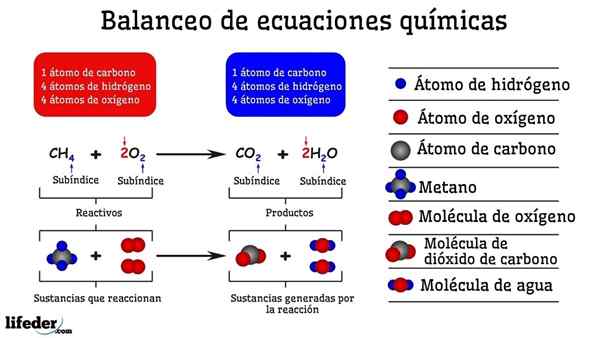 Beispiel für chemische Ausgleich der Reaktion zwischen Methan und zwei Sauerstoffmolekülen
Beispiel für chemische Ausgleich der Reaktion zwischen Methan und zwei Sauerstoffmolekülen Wenn es durch Versuch und Irrtum ausgeglichen wird, ist es so, als ob sie in einer der beiden Seiten des Subbaja entfernt wurden oder Atome hinzugefügt wurden. Bis die Subbaja nicht horizontal suspendiert ist, ist die chemische Gleichung nicht vollständig ausgeglichen. Auf allen Seiten kann es keine (erzeugen Materie) oder weniger Atome (zerstören) geben.
Einfache Ausgleiche Beispiele für Gleichungen
In den folgenden Beispielen sehen Sie ausgeglichene oder leicht ausgleichen chemische Gleichungen. Alle müssen gemeinsam haben, dass die Anzahl der Atome für jedes der Elemente vor und nach dem Pfeil gleich sein wird, sobald die chemische Gleichung ausgeglichen wurde.
Quecksilberoxidation
2Hg +o2 → hg2ENTWEDER2
Wir haben zwei Elemente: Quecksilber (HG) und Sauerstoff (O). Wir drücken die Anzahl ihrer Atome vor (Reagenzien) und dann (Produkte) des Pfeils aus:
Hg: 2 (links) - 2 (rechts)
Es kann Ihnen dienen: Molarenfraktion: Wie es berechnet wird, Beispiele, ÜbungenO: 2 (links) - 2 (rechts)
Die Gleichung ist ausgeglichen, weil Hg -Atome und oder auf beiden Seiten des Pfeils gleich sind.
Wasserstoffverbrennung
H2 + ENTWEDER2 → h2ENTWEDER
Wir haben wieder zwei Elemente: Wasserstoff (H) und Sauerstoff (O). Wiederholen Sie den vorherigen Schritt:
H: 2 - 2
O: 2 - 1
Auf der linken Seite befindet sich ein Sauerstoff mehr als in der rechten Seite. Wir müssen daher einen weiteren richtigen Sauerstoff hinzufügen. Dazu ändern wir die stöchiometrischen Koeffizienten, die die Zahlen sind, die den Formeln begleiten und vorausgehen. Wenn wir 2 vor H stellen2Oder wird uns geben:
H2 + ENTWEDER2 → 2H2ENTWEDER
H: 2 - 4
O: 2 - 2
Sauerstoff sind ausgeglichen. Aber keine Wasserdämpfer. Sie müssen jetzt links zwei Wasserdarsteller hinzufügen:
2H2 + ENTWEDER2 → 2H2ENTWEDER
H: 4 - 4
O: 2 - 2
Und die Gleichung ist schließlich ausgeglichen: gleiche Anzahl von H und oder vor und nach dem Pfeil.
Beachten Sie, dass stöchiometrische Koeffizienten (2 für h2 und 1 für die o2) Multiplizieren Sie die Einweis der Formeln. Diese Multiplikation gibt uns die Gesamtzahl der Atome für ein bestimmtes Element.
Magnesiumreduktion
Mg (nein3)2 + 2LI → Mg +2Lino3
Wir bewerten Atomnummern für jedes Element:
Mg: 1 - 1
Li: 2 - 2
N: 2 - 2
O: 6 - 6
Die chemische Gleichung ist bereits ausgewogen und es besteht keine Notwendigkeit, sie auszugleichen.
Gelöste Übungen
Bevor Sie fortfahren, um eine Gleichung auszugleichen, muss immer bestätigt werden, ob sie nicht mehr ausgeglichen ist. Das heißt, wir gehen mit der folgenden Übung fort:
Übung 1
Ausgeglichen oder nicht?
Glaube2ENTWEDER3 + H2O → Glaube (OH)3
Wir haben drei Elemente: Eisen (Glaube), Wasserstoff und Sauerstoff. Ein Vorschlag zum Zeitpunkt der Balance -Gleichungen ist es, die Atomnummern des weniger häufig vorkommenden Elements in der Gleichung zu zählen. was normalerweise anders ist von h und o. So zählen wir zunächst die Atome des Glaubens:
Es kann Ihnen dienen: MethylalicylatGlaube: 2 - 1
Index 3 von (OH)3 Multiplizieren Sie den Glauben nicht links. Für h und o haben wir:
H: 2 - 3
O: 4 - 3
Alle Elemente sind unausgeglichen.
Schwingen
Vor dem Gleichgewicht H und O müssen wir die Atome des Glaubens ausgleichen: das am wenigsten reichlich vorhandene Element, da es im Gegensatz zu 5 H und 7 oder 7 oder 7 kaum 3 Glauben gibt. Sie müssen dann rechts einen Glauben hinzufügen:
Glaube: 2 - 2
Was ist gleich, um einen 2 als stöchiometrischen Koeffizienten vor dem Glauben zu setzen (OH)3. Die Gleichung bleibt bleiben:
Glaube2ENTWEDER3 + H2O → 2Fe (OH)3
Glaube: 2 - 2
H: 2 - 6
O: 4 - 6
Aber das h und o oder weiter unausgeglichenen. Und h2Oder beitragen 2 h und wir fehlen 4 h. Deshalb werden wir zwei weitere h hinzufügen2Oder damit wir drei h haben können2ENTWEDER:
Glaube2ENTWEDER3 + 3H2O → 2Fe (OH)3
Und wir bewerten noch einmal:
Glaube: 2 - 2
H: 6 - 6
O: 6 - 6
Beachten Sie, wie sie sie ausbalancierten, sobald wir das H einst ausgeglichen haben. Die Gleichung ist endlich ausgeglichen.
Übung 2
Ausgeglichen oder nicht?
CH4 + ENTWEDER2 → co2 + H2ENTWEDER
Wir bewerten die Anzahl der Atome für alle vorliegenden Elemente:
C: 1 - 1
H: 4 - 2
O: 2 - 3
Kohlenstoff ist ausgeglichen, aber das Gleiche gilt nicht bei Wasserstoff und Sauerstoff. Die Gleichung ist unausgeglichen.
Schwingen
Da das C ausgeglichen ist, möchten wir die stöchiometrischen Koeffizienten von CH nicht ändern4 oder co2. Zumindest nicht im Prinzip.
Wir konzentrieren unsere Aufmerksamkeit auf H und O, insbesondere auf H. Weil? Denn wenn man die Gleichung sieht, ist es einfacher, h vor oder einfacher auszugleichen. Wir müssen 2 h nach rechts hinzufügen und einen Koeffizienten 2 vor H platzieren2ENTWEDER:
CH4 + ENTWEDER2 → co2 + 2H2ENTWEDER
C: 1 - 1
H: 4 - 4
O: 2 - 4
C und H sind ausgeglichen. Wir sind 2 oder links bleiben. Wenn jeder oder2 trägt 2 oder wir werden einen oder hinzufügen2 extra, damit sie 4 oder links sind. Dies ist das gleiche wie das Platzieren eines Koeffizienten 2 vor dem O2:
Kann Ihnen dienen: SchwefeloxidCH4 + 22 → co2 + 2H2ENTWEDER
C: 1 - 1
H: 4 - 4
O: 4 - 4
Und die Gleichung ist endlich ausgeglichen.
Übung 3
Ausgeglichen oder nicht?
N2 + H2 → NH3
Wir bewerten für unsere beiden Elemente N und H:
N: 2 - 1
H: 2 - 3
Die Gleichung ist nicht ausgeglichen.
Schwingen
Wir beginnen das n ausgeglichene N, das Element anders als h. Uns fehlt ein Recht und wie jeder NH3 trägt 1 n bei, wir müssen einen weiteren NH hinzufügen3 2 n:
N2 + H2 → 2nh3
N: 2 - 2
H: 2 - 6
Und jetzt vermissen wir die linke. Wenn jeder h2 Tragen Sie 2 h zur Gleichung bei, dann müssen wir zwei weitere hinzufügen, damit es 6 h gibt. Dies ist das gleiche wie das Platzieren eines stöchiometrischen Koeffizienten 3 vor H2:
N2 + 3H2 → 2nh3
N: 2 - 2
H: 6 - 6
Und die chemische Gleichung ist endlich ausgeglichen.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Chemistry Librettexts. (23. November 2020). Wie man ausgeglichene chemische Gleichungen schreibt. Erholt von: Chem.Librettexts.Org
- Wikipedia. (2020). Chemische Gleichung. Abgerufen von: in.Wikipedia.Org
- Prinzipien der Chemie. (S.F.). Schreiben und Ausgleich chemischer Gleichungen. [PDF]. Abgerufen von: Web.UNG.Edu
- Phet. (S.F.). Ausgleich von chemischen Gleichungen. Erholt von: Phet.Colorado.Edu
- Armando Marín b. (S.F.). Allgemeine Chemie: Ausgleich von Gleichungen. [PDF]. Erholt von: Depa.Fquim.Unam.mx

