Benzolgeschichte, Struktur, Eigenschaften, Derivate, verwendet, verwendet

- 5138
- 905
- Nick Laurén
Er Benzol Es ist eine organische Verbindung, die aus einem der einfachsten aromatischen Kohlenwasserstoffe besteht. Seine chemische Formel ist c6H6, von denen bekannt ist, dass die Beziehung zwischen Kohlenstoff und Wasserstoff gleich 1 ist; Das heißt, für jeden Kohlenstoff ist ein Wasserstoff damit verbunden.
Obwohl sein physisches Erscheinungsbild das einer farblosen Flüssigkeit ist, ist sie natürlich in Öl und Produkten zu finden, die daraus abgeleitet sind. Sein Geruch ist sehr charakteristisch, da er einer Mischung aus Klebstoff, Bitumen und Benzin ähnelt. Andererseits ist es eine flüchtige und brennbare Flüssigkeit.
 Lelfing mit Benzol. Quelle: Air1404 [CC von 4.0 (https: // creativecommons.Org/lizenzen/bis/4.0)]]
Lelfing mit Benzol. Quelle: Air1404 [CC von 4.0 (https: // creativecommons.Org/lizenzen/bis/4.0)]] Im oberen Bild wird ein Behälter oder eine Flasche mit Benzol gezeigt, vermutlich nicht analytischer Reinheit. Wenn Benzol -Dämpfe im gesamten Labor sofort aufgedeckt werden. Aus diesem Grund wird diese Flüssigkeit, die üblicherweise als einfaches Lösungsmittel verwendet wird, in einer Gas -Extraktorglocke manipuliert.
Sein Ihre Formel C6H6, Die Chemikalien des 19. Jahrhunderts haben zahlreiche mögliche Strukturen angehoben, die dem Anteil C/H entsprechen 1. Nicht nur das, sondern auch das Benzolmolekül musste spezielle Verbindungen so haben, dass seine ungewöhnliche Stabilität den Additionsreaktionen erklärt werden konnte; typisch für Alkene und Richtlinien.
Es war so, dass seine Links ein Rätsel für die Chemikalien dieser Zeit darstellten; Bis die Eigenschaft rief Aromatizität. Benzol ist viel mehr als das und es ist ein weiteres der vielen Beispiele für Synergie in der Chemie, bevor es als Hexacyclotrien (mit drei Bindungen c = c) gilt (C = C), und es ist viel mehr als das.
In der organischen Chemie ist Benzol ein klassisches Symbol, strukturelle Grundlage für mehrere polylaromatische Verbindungen. Aus seinem Sechseck werden Symphine von Derivaten durch aromatische elektrophile Substitution erhalten; Ein Ring, dessen Kanten an die Struktur grenzen, die neue Verbindungen definiert.
Tatsächlich werden seinen Derivaten die riesigen industriellen Zwecke für diejenigen geschuldet, die Benzol unter ihrem Rohstoff benötigen. Von der Herstellung von Textilkleber und Fasern bis hin zu Kunststoffen, Gummi, Pigmenten, Drogen und Sprengstoff. Auf der anderen Seite kommt natürlich Benzol in Vulkanen, Waldbränden, Benzin und im Rauch der Zigaretten vor.
[TOC]
Geschichte
Entdeckung und Namen
Seine Entdeckung stammt aus dem Jahr 1825, der normalerweise Michael Faraday verliehen wurde, als er sammelte und Experimente mit einem verbleibenden Ölprodukt des für die Beleuchtung verwendeten Gases durchführte. Diese Flüssigkeit enthielt einen Anteil von C/H in der Nähe von 1, weshalb sie als "Kohlenstoffwasserstoff" bezeichnet wurde.
Der Chemiker Auguste Laurent ernannte den seltsamen Kohlenwasserstoff "Pheno", der aus dem griechischen Wort abgeleitet ist. "Phaínein'Was bedeutet brillant (weil es nach dem Verbrennen des Gas erhalten wurde). Dieser Name wurde jedoch von der wissenschaftlichen Gemeinschaft nicht akzeptiert und nur als "Phenyl" herrscht, um sich auf das von Benzol abgeleitete radikale zu beziehen.
Aus dem Benzoin -Gummi gelang es dem Chemiker Eilhard Mitscherlich neun Jahre später, dieselbe Verbindung herzustellen; Es gab daher eine weitere Quelle für denselben Kohlenwasserstoff, den er als "Benzina" taufte. Sie betrachteten jedoch auch nicht den entsprechenden Namen, um davon auszugehen, dass es sich um ein Alkaloid wie Chinin handelte.
So ersetzten sie den Namen 'Bencina' durch 'Benzol'. Es gab jedoch wieder Widersprüche und Unstimmigkeiten, weil der Begriff "Benzol" Kohlenwasserstoff für einen Alkohol verwirrte. Damals wurde der Name 'Benzol' geboren, der zuerst in Frankreich und England verwendet wurde.
Es kann Ihnen dienen: Lithiumcarbonat (LI2CO3): Struktur, Eigenschaften, verwendetIndustrielle Produktion
Weder Beleuchtungsgas noch Benzoingummi waren geeignete Quellen, um Benzol bis große Skalen zu erzeugen. Charles Mansfield, der mit August Wilhelm von Hofmann zusammenarbeitet, isolierte 1845 das Benzol (zwanzig Jahre nach seiner Entdeckung) des Hulla Tar, seitlicher Produkte der Cola -Produktion.
So begann die industrielle Produktion von Benzol vom Hulla Tar. Die Verfügbarkeit von Benzol in massiven Mengen, erleichterte die Untersuchung seiner chemischen Eigenschaften und ermöglichte es ihm, sie mit anderen Verbindungen ähnlicher Reaktivitäten in Beziehung zu setzen. August Wilhelm von Hofmann prägte das Wort "aromatisch" für Benzol- und verwandte Verbindungen.
Historische Strukturen
August Kekulés Traum
Friedrich August Kekulé wird um 1865 mit der hexagonalen und zyklischen Struktur von Benzol ausgezeichnet, die sich aus einem seltsamen Traum mit Uroboros ergibt, der Schlange, die seinen eigenen Schwanz durch den Zeichnen eines Kreises beißt. Daher glaubte er, dass Benzol als sechseckiger Ring und andere Chemikalien angesehen werden könnte, die mögliche Strukturen angesprochen haben, die unten gezeigt werden:
 Benzolringstrukturen im Laufe der Geschichte vorgeschlagen. Quelle: Jü [Public Domain]
Benzolringstrukturen im Laufe der Geschichte vorgeschlagen. Quelle: Jü [Public Domain] Einige der oberen Strukturen könnten die Stabilität von Benzol rechtfertigen.
Buch, Ringe und Prisma
Beachten Sie, dass die dritte Struktur nicht einmal ein Ring ist, sondern ein dreieckiger Prisma, der 1869 von Albert Ladenburg vorgeschlagen wurde. Zu seiner linken Seite, ein offenes Buch, das 1867 von Sir James Dewar vorgeschlagen wurde; Und zu seiner Rechten, eine mit allen Wasserdingen, die in die Mitte des Rings gerichtet sind, vorgeschlagen von Henry Edward Armstrong im Jahr 1887.
Die erste Struktur, die 1867 von Adolf Karl Ludwig Claus vorgeschlagen wurde, ist ebenfalls sehr eigenartig, da C-C-Verbindungen gekreuzt werden. Und der letzte war Kekulés "Serpentine" -Ring, der 1865 träumte.
Was war der "Gewinner"? Die fünfte Struktur (von links nach rechts), die 1899 von Johannes Thiele vorgeschlagen wurde.
Dabei wurde der Resonanzhybrid zum ersten Mal betrachtet, was die beiden Kekulé -Strukturen kombinierte (den ersten Ring am Recht, ihn zu beobachten) und die Umzug der Elektronen und damit die bis dahin ungewöhnliche Stabilität von außerordentlich erklärte das Benzol.
Benzolstruktur
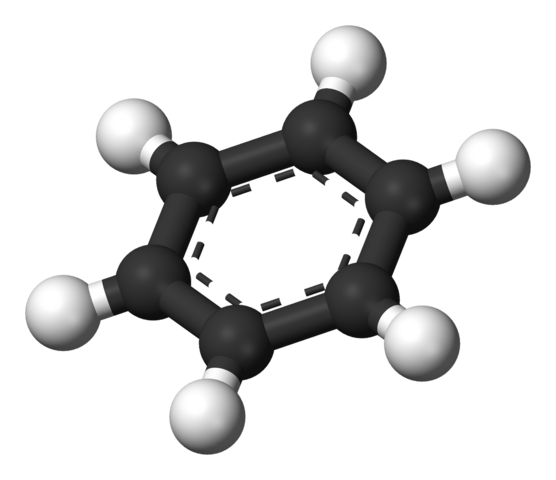 Benzol aromatischer Ring. Quelle: Benjah-BMM27 [Public Domain]
Benzol aromatischer Ring. Quelle: Benjah-BMM27 [Public Domain] Die von Thiele vorgeschlagene Struktur wird durch ein Modell von Kugeln und Balken gezeigt.
Das Benzolmolekül ist flach, wobei die Wasserstoffatome aus den Seiten des Rings zeigen. Alle Kohlenstoffatome haben SP -Hybridisierung2, Mit einem Orbital P Verfügbar, um das aromatische System zu etablieren, in das sechs Elektronen umziehen.
Diese Carbonos sp2 Sie sind elektronegativer als Wasserstoffe und daher die erste elektronische Dichte der letzteren entfernen (C. CSp2δ--Hδ+). Folglich hat die Mitte des Rings eine größere Elektronenkonzentration als seine Seiten.
Genauer gesagt kann das aromatische System als Wolke oder elektronisches Pad dargestellt werden, die durch beide Seiten des sechseckigen Rings erweitert wurden. und in der Mitte an den Seiten oder Kanten ein elektronischer Mangel.
Dank dieser Verteilung von elektrischen Ladungen können Benzolmoleküle durch Dipol-Dipolo-Kräfte miteinander interagieren. Die Atome hδ+ Sie spüren eine Anziehungskraft auf das aromatische Zentrum eines benachbarten Rings (darunter wird darunter dargestellt).
Ebenso können aromatische Zentren übereinander gestapelt werden, um die Induktion von Sofortdipolen zu bevorzugen.
Kann Ihnen dienen: AlotropyResonanz
 Strukturen und Resonanzhybride von Benzol. Quelle: Edgar181 von Wikipedia.
Strukturen und Resonanzhybride von Benzol. Quelle: Edgar181 von Wikipedia. Die beiden Kekulé -Strukturen sind oben im Bild und unter ihnen die Resonanzhybrid dargestellt. Wenn die beiden Strukturen immer wieder gleichzeitig auftreten, wird der Hybrid mit einem in der Mitte gezogenen Kreis dargestellt (ähnlich wie bei einem "hexagonalen Donut").
Der Hybridkreis ist wichtig, da er den aromatischen Charakter von Benzol (und den vieler anderer Verbindungen) angibt. Darüber hinaus weist er darauf hin, dass die Links nicht so lang wie C-C oder C = C sind; aber ihre Länge liegt zwischen beiden Enden. Somit wird Benzol nicht als Polyhen angesehen.
Das obige wurde durch die Messung der Längen der C-C-Verbindungen (139 pm) des Benzols gezeigt, die etwas länger sind als die C-H-Bindungen (109 PM).
Kristalle
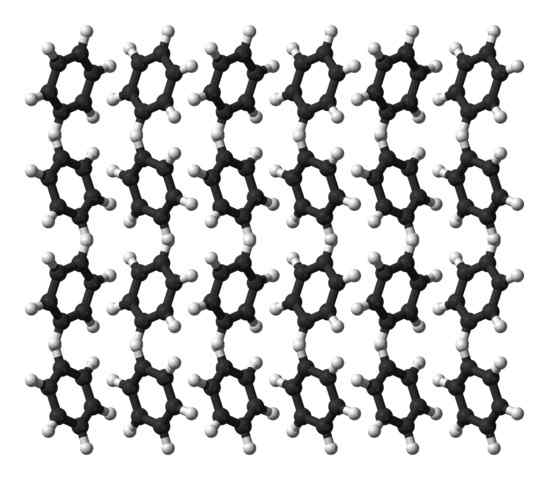 Benzolortorrombische Kristallstruktur. Quelle: Ben Mills [Public Domain]
Benzolortorrombische Kristallstruktur. Quelle: Ben Mills [Public Domain] Benzol ist eine Flüssigkeit bei Raumtemperatur. Seine intermolekularen Kräfte machen trotz eines so ausgeprägten Dipolmoments seine Moleküle in einer Flüssigkeit, die bei 80 ° C kocht. Wenn die Temperatur unter 5 ° C sinkt, beginnt das Benzol zu frieren, und so werden ihre entsprechenden Kristalle erhalten.
Benzolringe können strukturelle Muster annehmen, die in ihrem Feststoff definiert sind. Ihre Dipole machen sie nach links oder rechts "geneigt" und bilden Ränge, die in der Lage sind, durch eine Orthormortorrombzelle zu reproduzieren. Somit sind Benzolkristalle ortorrombisch.
Beachten Sie im überlegenen Bild, dass, wenn die Ringe geneigt sind, die Wechselwirkungen zwischen dem H zu bevorzugenδ+ und die aromatischen Zentren, die in früheren Unterabschnitten erwähnt werden.
Eigenschaften
Molekulare Masse
78.114 g/mol.
Aussehen
Farblose Flüssigkeit mit einem ähnlichen Geruch wie Benzin.
Siedepunkt
80ºC.
Schmelzpunkt
5,5ºC.
Zündungspunkt
-11ºC (geschlossener Tasse).
Self -Anmut -Temperatur
497.78ºC.
Dichte
0,8765 g/ml bei 20ºC.
Löslichkeit
Ein Liter kochendem Wasser kann sich kaum 3,94 g Benzol auflösen. Sein apolarer Charakter macht es praktisch nicht mit Wasser mischbar. Es ist jedoch mit anderen Lösungsmitteln wie Ethanol, Ethern, Aceton, Ölen, Chloroform, Kohlenstofftetrachlorid usw. mischbar.
Wasserdampfdichte
2.8 in der Luftbeziehung (dh fast dreimal mehr).
Dampfdruck
94,8 mm Hg bei 25 ° C.
Verbrennungswärme
-3267.6 KJ/Mol (für flüssige Benzol).
Verdampfungswärme
33,83 kJ/mol.
Oberflächenspannung
28,22 mn/m a 25ºC.
Brechungsindex
1.5011 bis 20ºC.
Derivate

Benzolhydrogene können durch andere Gruppen oder Atome ersetzt werden. Es kann einen oder mehrere Substitutionen geben, die den Substitutionsgrad bis zu den sechs ursprünglichen Hydrogenen erhöhen. Es gibt eine.
Zum Beispiel Benzeno als pH-H, wobei H eines seiner sechs Wasserstoffe ist. Wenn er sich daran erinnert, dass die Mitte des Rings eine größere elektronische Dichte aufweist, zieht Elektrophile an, die den Ring angreifen, um H in einer Reaktion als aromatische elektrophile Substitution zu ersetzen (Sear).
Wenn dieses H durch einen OH ersetzt wird, wird das PH-OH sein, Phenol wird sein; Ersetzen eines Cho3, PH-CH3, Toluol; Wenn es NH ist2, PH-NH2, Anilin; Oder wenn es die Cho ist2CH3, PH-CH2CH3, Ethylbenzol.
Derivate können gleich oder giftiger sein als Benzol oder im Gegenteil so komplex, dass sie zu einer wünschenswerten pharmakologischen Wirkung werden.
Kann Ihnen dienen: Calciumcarbid (CAC2): Struktur, Eigenschaften, erhalten, verwendet, verwendetAnwendungen
Es ist ein gutes Lösungsmittel für eine Vielzahl von Verbindungen, beispielsweise in Gemälden, Lacken, Klebstoffen und Beschichtungen.
Es kann auch Öle, Fette oder Wachse auflösen, sodass es als Essenz -Extraktor -Lösungsmittel verwendet wurde. Diese Eigenschaft wurde 1903 von Ludwig Roselius zur Dekaffein den Kaffee verwendet, eine Operation, die bereits aufgrund der Toxizität des Benzols nicht verwendet wurde. Ebenso wurde es in der Vergangenheit verwendet, um Metalle zu entbinden.
In einem seiner klassischen Verwendungen wirkt es nicht als Lösungsmittel, sondern als Additiv: Erhöhen Sie die Oktan von Benzin und ersetzen Sie Blei für diesen Zweck.
Benzolderivate können unterschiedliche Zwecke haben; Einige dienen als Pestizide, Schmiermittel, Waschmittel, Kunststoffe, Sprengstoff, Parfums, Farbstoffe, Kleber, Drogen usw. Wenn es in seiner Struktur einen Benzenic Ring gibt, ist es sehr wahrscheinlich, dass seine Synthese das Benzol verlassen hat.
Zu seinen wichtigsten Derivaten gehören: Cumeno, Xylol, Anilin, Phenol (für die Synthese von Phenolharzen), Benzoesäure (konservierungsmittel), Cyclohexan (für die Synthese des Nilon), Nitrobenzol, Resorcinol und Ethylbenzene).
Nomenklatur
Die Nomenklatur von Benzolderivaten variiert je nach Substitutionsgrad, was sind die Substituentengruppen und ihre relativen Positionen. So kann Benzol Affen, DI, Tri, Tetra usw. leiden., Substitutionen
Wenn die beiden Gruppen mit benachbarten Kohlenstoffen verbunden sind, wird die "Ortho" -Nennination verwendet. Wenn zwischen dem Trennen ein Kohlenstoff "Ziel" ist; Und wenn Kohlenstoffe in entgegengesetzten Positionen sind, für 'für'.
In den unteren Bildern werden Beispiele für Benzolderivate mit ihren jeweiligen Namen der IUPAC gezeigt. Sie werden auch von gemeinsamen oder traditionellen Namen begleitet.
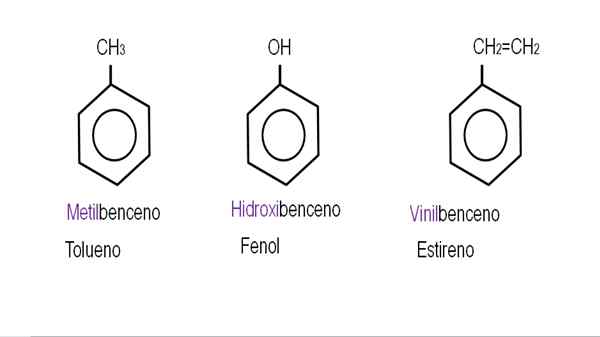 Monodersivierte Benzol. Quelle: Gabriel Bolívar.
Monodersivierte Benzol. Quelle: Gabriel Bolívar. 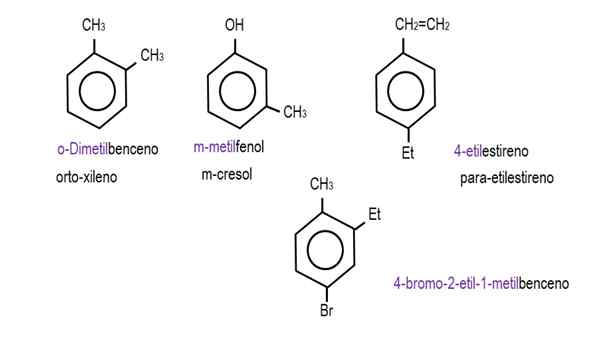 Andere Benzolderivate. Quelle: Gabriel Bolívar.
Andere Benzolderivate. Quelle: Gabriel Bolívar. Beachten Sie, dass im trisuierten Benzol die Ortho -Indikatoren und das Ziel, nützlich zu sein.
Toxizität
Benzol ist eine Verbindung, die sorgfältig manipuliert werden muss. Angesichts seines besonderen Geruchs können die unmittelbaren negativen Auswirkungen Erstickung, Schwindel, Kopfschmerzen, Zittern, Schläfrigkeit, Übelkeit und sogar Tod sein (vor einer hohen Belichtung). Wenn zusätzlich zu den bereits erwähnten Magenschmerzen und Anfällen Akute verursachen können.
Darüber hinaus sind langfristige Effekte unter konstanter Exposition gegenüber dieser Flüssigkeit krebserregend; Erhöht die Chancen, dass der Einzelne an einer Art Krebs leidet, insbesondere Blut: Leukämie.
Im Blut kann es die Konzentration der roten Blutkörperchen verringern, die Anämie verursachen und auch das Knochenmark und die Leber beeinflussen, wo es vom Körper aufgenommen wird, um noch mehr giftige Benzolderivate zu erzeugen. Zum Beispiel Hydroxiquinon. Es sammelt sich auch in den Nieren, Herz, Lungen und Gehirn an.
Verweise
- Morrison, r.T. Und Boyd, r. N. (1987). Organische Chemie. (5. Ausgabe). Addison-Wesley Iberoamericana.
- Carey, f. ZU. (2008). Organische Chemie. (6. Ausgabe). McGraw-Hill, Intermerica, Herausgeber s.ZU.
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. Amine. (10. Ausgabe.). Wiley Plus.
- Nationales Zentrum für Biotechnologie Information. (2019). Benzol. Pubchem -Datenbank. CID = 241, wiederhergestellt aus: Pubchem.NCBI.NLM.NIH.Regierung
- Wikipedia. (2019). Benzol. Abgerufen von: in.Wikipedia.Org
- Garcia Nissa. (2019). Was ist Benzol? - Verwendung, Struktur und Formel. Lernen. Erholt von: Studium.com
- Zentren für die Kontrolle und Prävention von Krankheiten. (4. April 2018). Fakten über Benzol. Erholt von: Notfall.CDC.Regierung
- Weltgesundheitsorganisation. (2010). Benzolexposition: Ein großes Problem der öffentlichen Gesundheit. [PDF]. Erholte sich von: wer.int
- Fernández Germán. (S.F.). Benzol -Nomenklaturprobleme. Organische Chemie. Erholt von: Chemicicaorganica.Org
- « Kosmopolitikkonzept, Ursprünge, Vision von Kant, Gesellschaft
- Touristengeographie -Objekt der Studie, Herkunft, Hilfswissenschaften »

