Beryllium History, Struktur, Eigenschaften, verwendet

- 4711
- 1078
- Medine Kedzierski
Er Beryllium Es ist ein metallisches Element, das zu Gruppe 2 oder IIA der Periodenplatte gehört. Es ist das hellste alkalische Metall in der Gruppe und wird durch das Be -Symbol dargestellt. Sein Atom und Kationen sind auch kleiner als die ihrer Kollegen (MG, CA, MR ...).
Aufgrund seiner ungewöhnlichen Lastdichte tritt dieses Metall normalerweise nicht isoliert auf. Sie kennen 30 Mineralien, die es enthalten, darunter: The Beryl (3Beo · Al2ENTWEDER3· 62· 2H2O) die Bertrandita (4beo.2SE2.2H2O), El Chrisoberilo (Beal2ENTWEDER4) und die Fenaquita (sei2Ja4).
 Metallic Beryll Pipitas. Quelle: w. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Metallic Beryll Pipitas. Quelle: w. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] La Esmeralda, ein kostbarer Stein, ist eine Variante der Beryll. Reines Beryllium ist jedoch nicht so auffällig; Es sieht hellgrauhellig aus (überlegenes Bild) und wurde in Form von Pepitas oder Dragees erreicht.
Das Beryllium hat eine Reihe charakteristischer physikalischer Eigenschaften. Es hat eine niedrige Dichte; hohes thermisches und elektrisches Verhalten sowie seine thermische Kapazität und Wärmeableitung; Es ist kein Magnetmetall; und hat auch eine geeignete Kombination aus Starrheit und Elastizität.
Alle diese Eigenschaften haben dazu geführt, dass Beryllium ein Metall mit vielen Anwendungen ist, die von der Verwendung in Kupferlegierungen für die Ausarbeitung von Werkzeugen bis hin zu ihrer Verwendung in Raketen, Flugzeugen, Autos, Kernreaktoren, X -Ray -Ausrüstung, Resonanz -Nuklearmagnetic usw. reichen, usw. .
Das Beryllium hat 10 bekannte Isotope, die von 5Sei a 14Sein, der der sein 9Sei der einzige Stall. Es ist auch ein sehr giftiges Metall, das insbesondere das Atmungssystem beeinflusst, sodass es eine Einschränkung seiner Verwendung hat.
[TOC]
Geschichte Ihrer Entdeckung
Das Beryllium wurde 1798 von Louis-Nicolas Vauguelin als kompositorisches Element des Berilo-Minerals sowie als Aluminium- und Beryllium-Silikat entdeckt.
Anschließend gelang es dem deutschen Chemiker Frederic Wöhler 1828, das Beryllium durch Reaktion von Kalium mit Berylliumchlorid in einem Platin -Topf zu isolieren.
Gleichzeitig und unabhängig der französische Chemiker Antoine Bussy erreichte auch die Isolierung von Beryllium. Wöhler war der erste, der den Namen Beryllium für Metall vorschlug.
Er erhielt seinen aktuellen Namen im Jahr 1957, da er zuvor aufgrund des süßen Geschmacks einiger Salze als Glucinium bekannt war. Um Verwirrung mit anderen süßen Geschmacksverbindungen und mit einer Pflanze namens Glucina zu vermeiden, wurde beschlossen, den Namen für Beryllium zu ändern.
Berily -Struktur
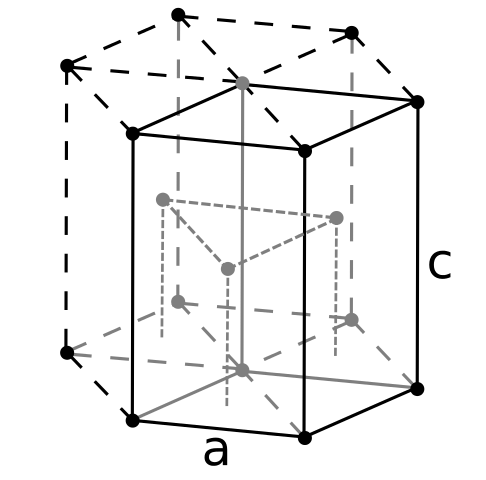 Berily Crign -Struktur. Quelle: Benutzer: Dornelf [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Berily Crign -Struktur. Quelle: Benutzer: Dornelf [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Da es sich. Berylil -Atome interagieren durch die metallische Bindung miteinander, so dass ihr "Meer von Elektronen" und Abstoßung zwischen dem Kernmodell die resultierende Glasstruktur modellieren.
Es kann Ihnen dienen: Periódinsäure (HIO4): Was ist, Struktur, Eigenschaften, verwendetDie schwarzen Kristalle von Beryllium werden dann gebildet. Diese Kristalle haben eine hexagonale Struktur (überlegenes Bild), wobei jeweils sechs Seiten Nachbarn und drei weitere in den oberen und unten geregelten Ebenen haben.
Es ist nützlich, schwarze Kristalle zu sein. Dies ist eine der kompaktesten Strukturen, die ein Metall annehmen kann. Und es ist sinnvoll, dass die so kleinen Atome von "Squeeze" beide die geringste Menge an Leere oder Anzahl von Löchern zwischen ihnen vermeiden.
Elektronische Konfiguration
1s22s2
Was entspricht 4 Elektronen, von denen 2 aus Valencia stammen. Wenn ein Elektron zum 2p -Orbital gefördert wird, haben zwei sp Hbíbridos -Orbitale. Somit können in Berylliumverbindungen lineare Geometrien x-be-X sein; Zum Beispiel das isolierte Becl -Molekül2, Cl---Cl.
Eigenschaften
Physische Beschreibung
Feste graue, helle und spröde Farbe.
Schmelzpunkt
1287 ºC.
Siedepunkt
2471 ºC.
Dichte
- 1,848 g/cm3 bei Raumtemperatur.
- 1,69 g/cm3 zum Schmelzpunkt (flüssiger Zustand).
Atomradio
232 Uhr.
Radio kovalent
90 Uhr.
Atomvolumen
5 cm3/mol.
Spezifische Wärme
1,824 j/g · mol bei 20 ºC.
Fusionshitze
12.21 kJ/mol.
Verdunstungswärme
309 kJ/mol.
Elektronegativität
1,57 auf der Paulingskala.
Standardpotential
1,70 V.
Schallgeschwindigkeit
12.890 m/s.
Wärmeausdehnung
11,3 µm/m · k bei 25 ° C.
Wärmeleitfähigkeit
200 w/m · k.
Chemische Eigenschaften
Das Beryllium ist mit einer Beryloxidschicht (Beeo) bedeckt, die als Luftschutz bei Raumtemperatur dient. Die Oxidation von Beryllium tritt bei Temperaturen von mehr als 1000 ° C auf, die als Berylliumoxid- und Beryllium -Nitridprodukte stammen.
Es ist auch resistent gegen die Wirkung von Salpetersäure 15 m. Aber es löst sich in Salzsäure und Alkalien wie Natriumhydroxid auf.
Anwendungen
Vorbereitung von Werkzeugen
Das Beryllium bildet Legierungen mit Kupfer, Nickel und Alumino. Insbesondere die Legierung mit Kupfer erzeugt Werkzeuge von großer Härte und Widerstand, was nur 2% des Gewichts der Legierung ausmacht.
Diese Werkzeuge erzeugen beim Schlagen des Eisen keine Funken.
Kann Ihnen dienen: Thermal: Struktur, Eigenschaften, Bildung, BeispieleAufgrund seiner geringen Dichte hat es ein leichtes Gewicht, das zusammen mit seiner Steifheit in Weltraumflugzeugen, Raketen, Raketen und Flugzeugen ermöglicht. Die Legierung mit Beryllium wurde zur Ausarbeitung von Autoteilen verwendet. Es wurde auch in der Ausarbeitung der Springs verwendet.
Aufgrund der großen Härte, die Beryllium seinen Legierungen verliehen hat, wurden diese in den Bremsen von Militärflugzeugen verwendet.
Spiegelausarbeitung
Das Beryllium wurde aufgrund seiner dimensionalen Stabilität und seiner Fähigkeit, einen hohen PURGERT zu haben, zur Herstellung von Spiegeln eingesetzt. Diese Spiegel werden in Satelliten und Brandsteuerungssystemen verwendet. Darüber hinaus werden Weltraumteleskope verwendet.
Bei ionisierender Strahlung
Das Beryllium ist ein Element mit niedriger Dichte, daher kann es als transparent für X -Strahlen angesehen werden. Diese Funktion ermöglicht ihre Verwendung bei der Konstruktion der Fenster der Röhrchen, die X -Strahlen, industrielle Anwendungen und medizinische Diagnose erzeugen.
Ebenso wird Beryllium in den Fenstern radioaktiver Emissionsdetektoren verwendet.
Im Magnetismus erzeugen Teams
Unter den Eigenschaften von Beryllium gehört kein magnetisches Element. Dies ermöglicht es, bei der Konstruktion von Artikeln von Magnetresonanzgeräten zu konstruieren, bei denen Magnetfelder mit großer Intensität erzeugt werden, wodurch alle Störungen minimiert werden.
Kernreaktoren
Aufgrund seines hohen Fusionspunkts wurde die Anwendung in Kernreaktoren und Keramik gefunden. Beryllium wird als Kernreaktionen Moderator und als Neutronenproduzent verwendet:
9Sei + 4Er (α) => 12C +N (Neutron)
Es wird geschätzt, dass für eine Million Beryl -Atome, die mit α -Partikeln bombardiert sind, bis zu 30 Millionen Neutronen auftreten. Genau diese nukleare Reaktion ermöglichte die Entdeckung des Neutrons.
James Chadwick bombardierte Beryllium -Atome mit α -Partikeln (er). Der Forscher beobachtete die Freisetzung subátomischer Partikel ohne elektrische Ladung, was zur Entdeckung von Neutronen führte.
Metallschutz
Fügen Sie eine Menge Beryllium auf der Oberfläche von Metallen hinzu, die oxidiert werden können, verleiht einen bestimmten Schutz. Zum Beispiel wird die Entflammbarkeit von Magnesium verringert und die Helligkeit von Silberlegierungen verlängert.
Wo befindet es sich?
Der Beryl ist im Pegmatit vorhanden, der mit Mica, Feldspat und Quarz assoziiert ist. Durch die Verwendung einer Flotationstechnik ist es möglich, eine Mischung aus Beryll und Feldspat zu trennen. Anschließend sind Feldspat und Beryl konzentriert und einer Behandlung mit Calciumhypochlorit unterzogen.
Es kann Ihnen dienen: Unterschiede zwischen organischen und anorganischen VerbindungenGefolgt von einer Behandlung mit Schwefelsäure und Kaliumsulfonat durch Verdünnung wird die Beryl -Flotation erreicht, wodurch sie vom Feldspat getrennt wird.
Die Beryll wird mit Natriumfluorosylikat und Soda bei 770 ° C behandelt, um Natriumfluoroberilat, Aluminiumoxid und Siliziumdioxid zu bilden. Dann wird das Berylliumhydroxid der Natriumhydroxidhydroxid -Gripporillösung ausgefällt.
Berylliumfluorid wird durch Reaktion von Berylhydroxid mit ammoniakalem Wasserstofffluorid gebildet, wodurch Ammoniumammonium erzeugt wird. Dies wird erhitzt, um Berylliumfluorid zu bilden, das mit heißem Magnesium behandelt wird, um Beryllium zu isolieren.
Risiken
Beryllium als fein geteiltes Metall in Form von Lösungen, trockener Staub oder Rauch, ist sehr giftig und kann Dermatitis erzeugen. Die größte Toxizität wird jedoch durch Inhalation erzeugt.
Zunächst kann Beryllium Überempfindlichkeit oder Allergie induzieren, die zu einer Belliose oder einer chronischen Erkrankung von Beryllium (CBD) werden kann. Dies ist eine schwere Krankheit, die durch eine Abnahme der Lungenkapazität gekennzeichnet ist.
Akute Krankheit ist selten. Bei chronischen Erkrankungen gibt es eine Farulombildung im gesamten Körper, insbesondere in der Lunge. Chronische Belliose verursacht fortschreitende Dyspnoe, Husten und allgemeine Schwäche (Asthenie).
Akute Belliose kann tödlich sein. In der Belliose tritt der fortschreitende Verlust der Atemfunktion auf.
Verweise
- Royal Society of Chemistry. (2019). Beryllium. Erholt von: RSC.Org
- Nationales Zentrum für Biotechnologie Information. (2019). Beryllium. Pubchem -Datenbank. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Helmestine, Anne Marie, ph.D. (15. März 2019). Beryllium Fakten. Erholt von: thoughtco.com
- Wikipedia. (2019). Beryllium. Abgerufen von: in.Wikipedia.Org
- Lentech b. V. (2019). Beryllium-be. Erholt von: lentech.com
- Unternehmensmaterial. (2019). Erfahren Sie mehr über das Element, das Beryllium gewonnen wurde: Beryllium.com
- D. Michaud. (12. April 2016). Beryllium Processing & Extraktionsproblem. 911 Metallurger. Erholt von: 911Metallurgist.com
- Timothy p. Hanusa. (5. Januar 2016). Beryllium. Encyclopædia Britannica. Erholt von: Britannica.com
- Lesen s. Neuer Mann. (2014). Beryllium -Krankheit. MSD -Handbuch. Erholt von: MSDMANUALS.com
- « Sportpsychologiegeschichte, Ziele und Profile
- Soziale Globalisierung soziale Dimension, Vorteile und Beispiele »

