Berkelio (BK) Struktur, Eigenschaften, erhalten, verwendet, verwendet

- 2208
- 393
- Lewis Holzner
Er Berkelium Es ist ein chemisches Element, dessen Symbol Bk ist. Es gehört zur Klasse der Actiniden, die sein achtes Mitglied ist. Ihre Atomnummer ist 97. Es ist ein synthetischer metallischer Feststoff. Dieses Element wird nicht natürlich über der Erdkruste gefunden. Es ist in kleinen Mengen in verbrauchten Kernbrennstoffen vorhanden und hat einen silbernen Glanz.
Aufgrund der Tests von Atomwaffen gibt es aufgrund schwerwiegender Unfälle in Atomenergieanlagen wie Tschernobyl und durch die Freisetzung, die aus Abfällen aus Kernenergieanlagen auftritt.
 Symbol, Anzahl und Atommasse des Berkelio -Elements. Quelle: ME/CC BY-S (https: // createRecommons.Org/lizenzen/by-sa/2.5). Quelle: Wikimedia Commons.
Symbol, Anzahl und Atommasse des Berkelio -Elements. Quelle: ME/CC BY-S (https: // createRecommons.Org/lizenzen/by-sa/2.5). Quelle: Wikimedia Commons. Ein praktischer Nutzen für Berkelio wurde nicht gefunden, da er in sehr geringen Mengen auftritt und die Tatsache, dass alle Isotope (BK -Atome mit unterschiedlicher Anzahl von Neutronen im Kern) radioaktiv sind. Die Hauptanwendung wurde in wissenschaftlichen Studien gelten.
Obwohl ihre Isotope künstlich in speziellen Labors produziert und von Expertenpersonal behandelt werden, sollten die Schäden, die die gefährliche Strahlung emittiert, immer berücksichtigt werden.
[TOC]
Nomenklatur
- Berkelio, BK -Symbol.
- Berkelio-243, BK-243 oder 243BK: Berkelio Isotop mit Atommasse 243.
Entdeckung
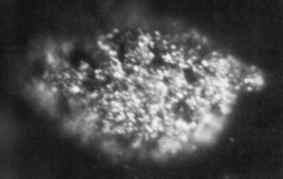 1,7 Mikrofotographie -Mikrogramm von festem Metallic Berkelio, das 1969 erhalten wurde. Oak Ridge National Laboratory, US -amerikanisches Ministerium für Energie- / Öffentlichkeitsbereich. Quelle: Wikimedia Commons.
1,7 Mikrofotographie -Mikrogramm von festem Metallic Berkelio, das 1969 erhalten wurde. Oak Ridge National Laboratory, US -amerikanisches Ministerium für Energie- / Öffentlichkeitsbereich. Quelle: Wikimedia Commons. Es wurde erstmals 1949 von Wissenschaftlern Glen Seeborg, Stanley G produziert. Thompson und Al Ghiorso an der Berkeley University in Kalifornien, als sie den Americio-241 mit hochenergetischen Alpha-Partikeln unter Verwendung eines Cyclotron (ein Partikelbeschleuniger) bombardierten.
Unmittelbar nach der Bestrahlung wurde das Material ordnungsgemäß aufgelöst und durch eine Ionenaustauschharzsäule geführt, wobei eine Ammoniumcitratlösung als Eluent verwendet wurde.
Auf diese Weise erhielten sie ein Isotop von Elementnummer 97 mit 243 Atommasse, die Alpha -Partikel ausstrahlt und ein halbes Leben von 4,5 Stunden aufweist.
Elementname
Zunächst schlugen mehrere Forscher vor, dass das Element den Namen eines seiner Entdecker, Glen Seeborg, annimmt, da er sich in mehreren Jahren in mehreren Jahren geschafft hatte, 10 Elemente zu synthetisieren, um 10 Elemente zu synthetisieren.
Kann Ihnen dienen: BecherDie offizielle Organisation International Union of Pure and Applied Chemistry oder IUPAC (Akronym für Englisch Internationale Union der reinen und angewandten Chemie) beschloss, den Namen "Berkelio" zuzuweisen, weil er an der Universität und der Stadt Berkeley (Kalifornien) erhalten worden war.
 Auftritt eines Gebiets der Universität Berkeley, Kalifornien. Autor: Sarangib. Quelle: Pixabay.
Auftritt eines Gebiets der Universität Berkeley, Kalifornien. Autor: Sarangib. Quelle: Pixabay. Der Name Berkeley stammt aus dem Angloirandés -Philosophen George Barkeley, einem Namen, dessen Aussprache in den USA sich dann in den USA änderte, als die Stadt und die Universität 1869 gegründet wurden.
Dies war beiläufig das Jahr, in dem Dmitri Mendeléyev seinen ersten periodischen Tabelle veröffentlichte und die Existenz neuer Elemente wie Berkelio vorhergesagt hatte.
Elektronische Struktur
Die elektronische Konfiguration lautet:
1S2; 2S2 2P6; 3S2 3P6 3D10; 4S2 4P6 4D10 4F14; 5S2 5P6 5D10; 6S2 6P6; 5F9 7S2,
oder kompakt:
[RN] 5F9 7S2.
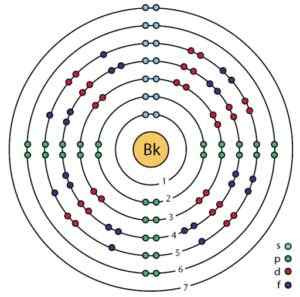 Elektronische Struktur von Berkelio. Orbitale und Elektronen sind zu sehen. Eine Gefahr.ScienceWriter/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons.
Elektronische Struktur von Berkelio. Orbitale und Elektronen sind zu sehen. Eine Gefahr.ScienceWriter/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons. Erhalten
Die erste Probe des Metalls wurde 1969 durch eine Fluoridreduktionsreaktion (BKF3) Mit Lithiummetall (Li) bei einer Temperatur von 1300 K.
Um dünne Metallblätter zuzubereiten, wird BKO -Oxid reduziert2 Mit Torio (Th) oder Metallic Lantano.
Berkelios physikalische Eigenschaften
Körperlicher Status
Metallic Solid.
Das Berkelio -Metall hat zwei kristalline Formen: Alpha (doppelkompaktes Sechseck) und Beta (Kubikmitte auf Gesichtern).
Atommasse
247
Schmelzpunkt
1050 ºC (Alpha -Form)
986 ° C (Beta -Form)
Siedepunkt
2627 ºC
Dichte
14,78 g/cm3 (Alpha -Form)
13,25 g/cm3 (Beta -Form)
Paramagnetismus
Nach einigen Quellen zeigen bestimmte Berkelio -Verbindungen paramagnetische Eigenschaften, was bedeutet, dass sie von Magnetfeldern angezogen werden.
Dieses Merkmal ist paramagnetischer Typ, da bei der Suspendierung der Magnetwirkung das Material solche Eigenschaften nicht allein beibehält.
Chemische Eigenschaften
Bei hohen Temperaturen wird das metallische Berkelio in Luft oder Sauerstoff schnell oxidiert und bildet seine Oxide. Es ist leicht löslich in Mineralsäuren und freisetzt Wasserstoffgas H2 und BK -Ionen bilden3+.
Kann Ihnen dienen: Aluminiumhydrid (Alh3): Struktur, Eigenschaften, verwendetOxidationszustände
Die ersten Untersuchungen dieses Elements waren auf Ionenaustausch- und Coprezipitationsexperimente beschränkt, mit denen beobachtet wurde, dass der Oxidationszustand +3 stabil ist und der +4 in wässriger Lösung zugänglich ist, da der BK3+ Es kann durch das Bromato -Ion (Bruder) oxidiert werden4-) BK geben4+.
BK -Stabilisierung4+
Im Jahr 2017 wurde die Stabilisierung des BK gemeldet4+ In Lösung unter Verwendung der Verbindung, die durch Hydroxipiridinongruppen gebildet wurde, vereint eine Polyaminstruktur (als Ligand 3,4,3-LI (1,2-Hop))).
Diese Verbindung hat acht Orte, an denen sich das Ion verbindet, was den Sauerstoffatomen der Gruppen c = o und n-oh entspricht, wobei das BK verließ4+ fest mit Ligand verbunden und stabil bleibt.
Feste Verbindungen
Der Bk4+ kann mit CERIO (CE COPRECIPITIERT4+) oder Zirkonium (zr4+) in Phosphat oder Yodato. Es kann auch in BIS-Hexanlösungen (2-Ethylhexil) Wasserstoffophosphat oder ähnlichem Akzeptanz extrahiert werden.
Die erste Berkelio -Verbindung, die in sichtbaren Mengen auftrat, war Chlorid (BKCL3), von denen 1962 0,000000003 Gramm erhalten wurden. Seitdem konnten mehrere Berkelio -Verbindungen vorbereiten und studieren.
Sie können zum Beispiel Phosphat (BKPO) erwähnt werden4), Oxychlorid (BKOCL), Fluoride (BKF3 und Bkf4), Dioxid (BKO2), Trioxid (BK2ENTWEDER3), Yodatos (bk (io3)3 und bk (io3)4), Chlorhydrat [BKCL2(H2ENTWEDER)6] Cl, Oxalat, organomethalische Verbindungen und Koordinationsverbindungen unter anderem.
Neuer Oxidationszustand +5
Im Jahr 2018 gelang es einer Gruppe von Ermittlern aus mehreren Ländern, einen Nitratkomplex mit Pentavalent Berkelio (BK) zu produzieren5+) deren Formel BKO ist2(NEIN3)2-, durch Eliminieren von zwei No Molekülen2 des BK -Ions (nein3)4-, (Bk3+).
Berechnungen für Computerenergie bestätigten, dass der Oxidationszustand +5 derjenige ist, der die größte Stabilität in diesem Berkenilo -Nitratkomplex hat, daher der wahrscheinlichste.
Isotope
Aus Berkelio wurden 14 Isotope mit Atommassen von 238 bis 251 synthetisiert. Alle sind radioaktiv.
Es kann Ihnen dienen: Benchilo: Benzylhydrollee, Karbokalationen, BenzylradikaleDas stabilste ist Berkelio-247, dessen Halbwertszeit 1380 Jahre beträgt. Jedes Atom dieses Isotops beim Zerfall emittiert ein Alpha-Partikel und bildet ein Atom von Amerika-243.
Der BK-249 hat eine Halbwertszeit von 330 Tagen, erleidet Beta-Verfall und wird Californio-249.
Anwendungen
Da sie nur sehr kleine Mengen dieses Elements erhalten konnten, wird es nur in der grundlegenden wissenschaftlichen Forschung verwendet.
Bei der Erlangung schwererer Elemente
Das Isotope BK-249 hat eine relativ lange Halbwertszeit und es ist möglich.
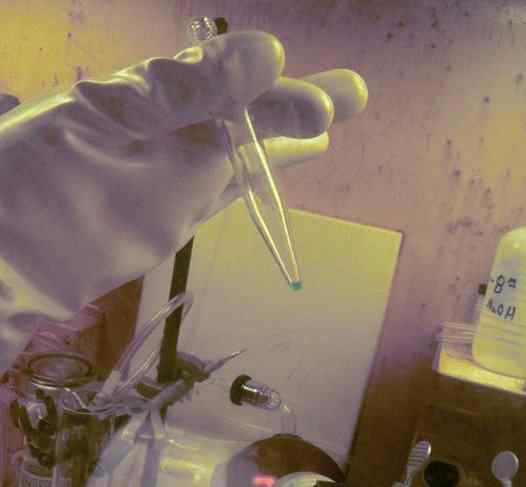 BK -Mikrokantität in einem Reagenzglas gelöst. 250 Tage wurden verwendet, um es zu erhalten. Der Radioaktivitätsschutzhandschuh dieses Elements kann beobachtet werden. Ornl, Department of Energy / Public Domain. Quelle: Wikimedia Commons.
BK -Mikrokantität in einem Reagenzglas gelöst. 250 Tage wurden verwendet, um es zu erhalten. Der Radioaktivitätsschutzhandschuh dieses Elements kann beobachtet werden. Ornl, Department of Energy / Public Domain. Quelle: Wikimedia Commons. In physikochemischen Studien
Die mit dem BK durchgeführten Forschung ermöglicht präzisere Extrapolationen über die Eigenschaften und das Verhalten anderer Elemente, die in der Schauspielreihe folgen.
Risiken
Berkelio ist ein radioaktives Element. Die Freisetzung von Radioaktivität in der Umwelt kann alle Arten von Tieren und Pflanzen erreichen, die ihnen Schäden verursachen. Verschlechterung kann sich in aufeinanderfolgenden Generationen ansammeln.
 Kernenergieanlagen sind radioaktiv und daher sehr gefährlich. Autor: AR130405. Quelle: Pixabay.
Kernenergieanlagen sind radioaktiv und daher sehr gefährlich. Autor: AR130405. Quelle: Pixabay. Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Berkelium - BK (Element). Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Weiß, f.D. et al. (2019). Zeitgenössische Chemie von Berkelium und Kalifornien. Chemie 2019 6. August; 25 (44): 10251-10261. Von PubMed geborgen.NCBI.NLM.NIH.Regierung.
- Blei, d.R. (Herausgeber) (2003). CRC -Handbuch für Chemie und Physik. 85th CRC Press.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Kelley, m.P. et al. (2018). Anleihekovalecy- und Oxidationszustand von Actinid INS mit dem therapeutischen Chelatmittel 3,4,3-LI (1,2-Hopo) komplexiert. Inorg. Chem. 2018 7. Mai; 57 (9): 5352-5363. Von PubMed geborgen.NCBI.NLM.NIH.Regierung.
- Kovács, a. et al. (2018). Pentavalent Curium, Berkelium und Californium im Nitratkomplex: Erweiterung der Aktinidchemie und Oxidationszustände. Chem. 2018 6. August; 57 (15): 9453-9467. Von PubMed geborgen.NCBI.NLM.NIH.Regierung.
- Orlova, a.Yo. (2007). Chemie und strukturelle Chemie von wasserfreiem Totravalenten Actinid-Orthophosphätern. In der strukturellen Chemie anorganischer Aktinidverbindungen. Von Scientedirect erholt.com.
- Choppin, g. et al. (2013). Die Actinid- und Transaktinidelemente. In Radiochemistry and Nuclear Chemistry (vierte Ausgabe). Von Scientedirect erholt.com.
- Peterson, j.R. und Hobart, D.UND. (1984). Die Chemie von Berkelium. Fortschritte anorganische Chemie, Band 28, 1984, Seiten 29-72. Von Scientedirect erholt.com.
- Royal Society of Chemistry. (2020). Berkelium. RSC erholt sich.Org.

