Struktur, Funktion, Mechanismus, Bedeutung der Kalium -Natriumpumpe
- 2758
- 569
- Rieke Scheer
Der Kalium -Natriumbombe Es handelt sich um eine Proteinstruktur, die in einem breiteren Satz von Molekülen enthalten ist, die in vielen Zellmembranen vorhanden sind, und die für den aktiven Transport von Ionen oder anderen kleinen Molekülen gegen seine Konzentrationsgradienten verantwortlich sind. Sie nutzen die durch ATP -Hydrolyse freigesetzte Energie und deshalb werden sie allgemein als ATASAS bezeichnet.
Die Kalium -Natriumpumpe ist ein Na+/K+ATPay, da sie die im ATP -Molekül enthaltene Energie zum Bewegen des Natriumes in der Zelle freigibt und gleichzeitig Kalium einführt.
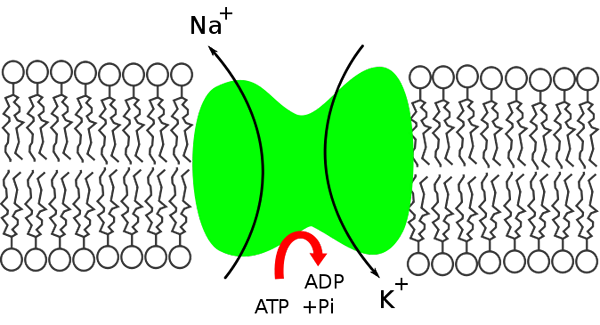
 Kalium -Natriumbombenschema. Außen- und Innenraum der Zelle. (Quelle: Miguferig, über Wikimedia Commons)
Kalium -Natriumbombenschema. Außen- und Innenraum der Zelle. (Quelle: Miguferig, über Wikimedia Commons) In der Zelle ist das Natrium weniger konzentriert (12 meq/l) als außen (142 meq/l), während Kalium außerhalb (4 meq/l) konzentriert ist (140 meq/l) mehr konzentriert ist.
Atasas -Bomben werden in drei große Gruppen eingeteilt:
- Ionische Pumpen vom Typ F und V: Sie sind recht komplexe Strukturen, sie können aus 3 verschiedenen Arten von Transmarket -Untereinheiten und bis zu 5 assoziierten Polypeptiden in Cytosol bestehen. Sie fungieren als Protonentransporter.
- ABC Superfamilie (auf Englisch ZUTp-BEinweichen CAssette = ATP -Union -Kassette): Integriert durch mehr als 100 Proteine, die als Ionenthändler, Monosaccharide, Polysaccharide, Polypeptide und sogar andere Proteine fungieren können.
- Ionische Pumpen der Klasse P: gebildet von mindestens einer transmembraalen Alpha -katalytischen Untereinheit, die über eine Gewerkschaftsstelle für die ATP und eine kleine β -Untereinheit verfügt. Während des Transportprozesses ist die α -Untereinheit Phosphoryila und daher der Name „P“.
Die Kalium -Natrium -Bombe (Na+/k+ATPASA) gehört zur Gruppe der Ionischen Pumpen der Klasse P und wurde 1957 von Jens Skou, einem dänischen Forscher, entdeckt, als er den Wirkungsmechanismus der Anästhetik im Nerven eines Krabbens (Krabben) untersuchte ((Carcinus maenas); Arbeiten, für die der Nobelpreis für Chemie 1997 vergeben wurde.
 Kalium -Natriumbombe. Nakpompe2.JPG: Phi-Gastrein bei Kälte.Wikipediaderivative Arbeit: Sonia/CC BY-S (http: // creativecommons.Org/lizenzen/by-sa/3.0/)
Kalium -Natriumbombe. Nakpompe2.JPG: Phi-Gastrein bei Kälte.Wikipediaderivative Arbeit: Sonia/CC BY-S (http: // creativecommons.Org/lizenzen/by-sa/3.0/) [TOC]
Kalium -Natriumpumpenstruktur
Die Kalium -Natriumpumpe ist ein Enzym, das aus Sicht ihrer quaternären Struktur durch 2 ALFA (α) -Proteinuntereinheiten und zwei Beta -Typen (β) gebildet wird.
Es ist daher ein α2β2 -Tetramer vom Typ α2β2, dessen Untereinheiten umfassende Membranproteine sind, dh sie überqueren die Lipiddoppelschicht und haben sowohl intra als auch zusätzliche cytosolische Domänen.
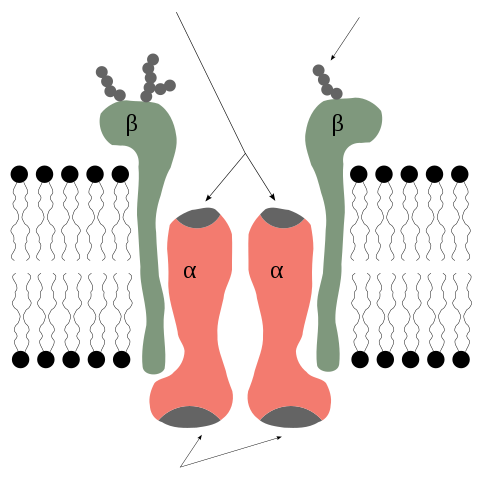 Alpha- und Beta -Untereinheiten der Kaliumpumpe. Rob Cowie/CC BY-SA (http: // creativecommons.Org/lizenzen/by-sa/3.0/)
Alpha- und Beta -Untereinheiten der Kaliumpumpe. Rob Cowie/CC BY-SA (http: // creativecommons.Org/lizenzen/by-sa/3.0/) Alpha -Untereinheiten
Die α -Untereinheiten sind solche, die die Gewerkschaftsstellen für den ATP und für die Na+ - und K+ -Ionen enthalten und die katalytische Komponente des Enzyms darstellen, und die eine, die die Funktion der Bombe selbst ausübt.
Die α-Untereinheiten sind große Polypeptide mit einem Molekulargewicht von 120 kDa, 10 transmembranalen Segmenten und mit ihren N- und C-terminalen Enden auf der zytosolischen Seite.
Sie haben an den intrazellulären Seitengewerkschaftsstellen für den ATP und für den Na+sowie einen Aspartatrest in Position 376, der die vom Phosphorylierungsprozess während der Aktivierung der Pumpe erlittene Stelle darstellt.
Die Bindungsstelle für das K+ ist anscheinend auf der extrazellulären Seite.
Beta -Untereinheiten
Die β -Untereinheiten scheinen nicht direkt an der Pumpfunktion teilzunehmen, aber in ihrer Abwesenheit tritt diese Funktion nicht auf.
Die β -Untereinheiten haben ein Molekulargewicht von jeweils etwa 55 kDa und sind Glykoproteine mit einer einzelnen Transmarket -Domäne, deren Glucid -Abfall in die extrazelluläre Region eingeführt wird.
Kann Ihnen dienen: Basalblatt: Eigenschaften, Histologie und FunktionenSie scheinen im endoplasmatischen Retikulum notwendig zu sein, wo sie zur ordnungsgemäßen Faltung der α -Untereinheiten und dann auf der Ebene der Membran beitragen würden, um den Komplex zu stabilisieren.
Beide Arten von Untereinheiten sind heterogen und wurden bisher α1, α2 und α3 -Isoformen für UNA und β1, β2 und β3 für den anderen beschrieben. Das α1 wird in den Membranen der meisten Zellen gefunden, während α2 in Muskel, Herz, Fettgewebe und Gehirn und α3 in Herz und Gehirn vorhanden ist.
Die β1 -Isoform ist die diffusste Verteilung, obwohl es in einigen Geweben wie vestibulären Zellen des inneren Ohrs und der glykolytischen Muskelzellen der schnellen Reaktion fehlt. Letztere enthalten nur β2.
Die verschiedenen Strukturen der Untereinheiten, aus denen die Na+/K+ -Pumpe in den verschiedenen Geweben besteht.
Kaliumpumpenfunktion
Für jede betrachtete Zeit besteht die Plasmamembran eine Trennungsgrenze zwischen dem entsprechenden Kompartiment zum Innenraum einer Zelle und derjenige, die die extrazelluläre Flüssigkeit darstellt, in die sie eingetaucht ist.
Beide Kompartimente verfügen über eine qualitativ unterschiedliche Zusammensetzung.
Substanzen, die in beiden Kompartimenten vorhanden sind. Dies ist der Fall vieler Ionen.
Homöostase Wartung
Die Na+/K+ -Pumpe erfüllt eine grundlegende Funktion bei der Aufrechterhaltung der intrazellulären Homöostase durch Kontrolle von Natrium- und Kaliumionenkonzentrationen. Diese Wartung der Homöostase erreicht es dank:
- Ionentransport: Natriumionen einführt und Kaliumionen ausgeben, durch den es auch die Bewegung anderer Moleküle durch andere Transporter fördert, die entweder von der elektrischen Ladung oder der inneren Konzentration dieser Ionen abhängen.
- Zellvolumensteuerung: Die Einführung oder die Ausgabe von Ionen impliziert auch Zentre -Wasserbewegungen der Zelle, sodass die Pumpe an der Zellvolumensteuerung teilnimmt.
- Membranpotentialerzeugung: Die Vertreibung von 3 Natriumionen pro 2 Kaliumionen, die eingeführt werden, verursacht die Membran. Dieser Unterschied wird als Ruhepotential bezeichnet.
Das Na+ hat eine extrazelluläre Konzentration von etwa 142 mEq/l, während seine intrazelluläre Konzentration nur 12 mEq/l beträgt; Das K+hingegen ist in der Zelle (140 meq/l) stärker konzentriert als außerhalb dessen (4 meq/l).
Obwohl die elektrische Ladung dieser Ionen ihren Durchgang durch die Membran nicht zulässt, gibt es Ionenkanäle, die sie (selektiv) erlauben, die die Bewegung bevorzugen, wenn die Kräfte, die diese Ionen normalerweise bewegen.
Kann Ihnen dienen: Membranrezeptoren: Funktionen, Typen, wie sie funktionierenJetzt haben diese Konzentrationsunterschiede eine große Bedeutung in der Erhaltung der Homöostase des Organismus und muss in einer Art Gleichgewicht aufrechterhalten werden, die verloren gehen würde.
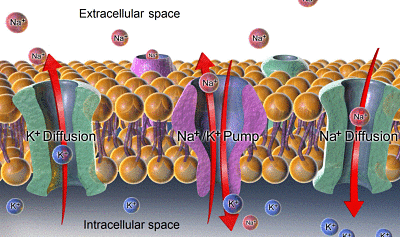 Verbreitung und Kaliumnatrium (Quelle: Bruceblaus. Wenn Sie dieses Bild in externen Quellen verwenden, kann es als: Blaussen bezeichnet werden.COM Staff (2014). "Medizingalerie von Blaussen Medical 2014". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.010. ISSN 2002-4436.Derivat von Mikael Häggström/CC von (https: // creativecommons.Org/lizenzen/bis/3.0) über Wikimedia Commons)
Verbreitung und Kaliumnatrium (Quelle: Bruceblaus. Wenn Sie dieses Bild in externen Quellen verwenden, kann es als: Blaussen bezeichnet werden.COM Staff (2014). "Medizingalerie von Blaussen Medical 2014". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.010. ISSN 2002-4436.Derivat von Mikael Häggström/CC von (https: // creativecommons.Org/lizenzen/bis/3.0) über Wikimedia Commons) - Der Konzentrationsunterschied für das Na+ zwischen Innenraum und außerhalb der Zelle erzeugt einen chemischen Gradienten, der das Natrium nach innen drückt und dieses Ion ständig eindringt und tischt, um diesen Unterschied zu zerstreuen, dh die Konzentrationen auf beiden Seiten zu entsprechen.
- Der Kaliumgradient wird in die entgegengesetzte Richtung gehalten, dh von innen nach außen, sodass die konstante Ausgabe des Ions und deren interne Verringerung und externer Anstieg ermöglicht werden.
Die Funktion der Na+/K+ -Pumpe ermöglicht die Extraktion des durch Diffusion durch Kanäle oder durch andere Transportwege eingegebenen Natrium und die Wiedereinführung des Kalium.
Mechanismus (Prozess)
Der Wirkungsmechanismus der ATPase Na+/K+ besteht aus einem katalytischen Zyklus, der Transferreaktionen einer Phosphorylgruppe (PI) und Konformationsänderungen des Enzyms, der von einem Zustand E1 zu einem E2 -Zustand übergeht, impliziert.
Die Operation erfordert das Vorhandensein von ATP und Na+ in der Zelle und K+ in der extrazellulären Flüssigkeit.
Vereinigung von Natriumionen zum Transporter
Der Zyklus beginnt im Konformationszustand E1 des Enzyms, in dem es 3 zytosolische Stellen mit Na+ -Ver Union und hoher Affinität (km von 0,6 mm) gibt, die vollständig besetzt sind, weil die Intra -Konzentration des Ionen (12 mm) zulässt.
ATP -Hydrolyse
In diesem Zustand (E1) und mit dem an seinen Gewerkschaftsstellen befestigten Na+ wird das ATP im zytosolischen Sektor des Moleküls an seiner Stelle befestigt eine Konformationsänderung zum Zustand E2.
Vertreibung von 3 Natriumionen und Einführung von 2 Kaliumionen
Die Konformationsänderung des E2 -Staates impliziert, dass die Na+ Union -Standorte in das Ausland gelangen, ihre Affinität zu dem Ion stark abnimmt und in der extrazellulären Flüssigkeit freigesetzt wird, während gleichzeitig die Affinität der Unionstorte zu K+ zunimmt Und diese Ionen binden an die Pumpe.
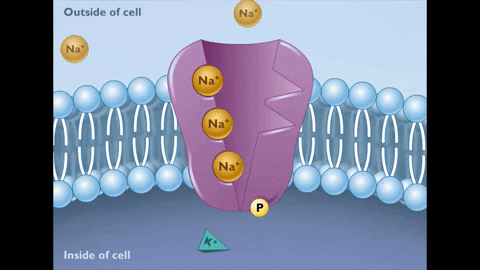 Während des Staates E2 werden die Ionen von Na+ auf der anderen Seite der Membran freigesetzt.
Während des Staates E2 werden die Ionen von Na+ auf der anderen Seite der Membran freigesetzt. 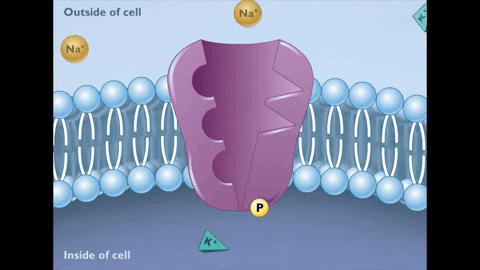 Dieser neue Zustand der Pumpe erzeugt wiederum Affinität für die Vereinigung von K Ionen+
Dieser neue Zustand der Pumpe erzeugt wiederum Affinität für die Vereinigung von K Ionen+ Umkehrung von E2 nach E1
Sobald die Na+ freigesetzt und der K+ vereint ist.
Wenn diese Änderung auftritt.
Bedeutung
Bei der Aufrechterhaltung der Zellosmolarität
Die Na+/K+ -Bombe war in den meisten, wenn nicht in allen Säugetierzellen vorhanden, in denen sie allgemein wichtig ist, indem sie zur Aufrechterhaltung ihrer Osmolarität und damit ihres Volumens beiträgt.
Kann Ihnen dienen: Peroxidasen: Struktur, Funktionen und TypenDer kontinuierliche Eintritt von Natriumionen in die Zelle kräftigt eine Zunahme der intrazellulären Anzahl von osmotisch aktiven Partikeln, was den Wassereintritt induziert.
In der Bildung des Membranpotentials
Da diese Pumpen nur 2 K+ pro 3 Na+ einführen, die sie herausnehmen, verhalten sie sich elektrogenisch, was bedeutet, dass sie interne elektrische Ladungen "dekompensatieren" und die Produktion des charakteristischen Membranpotentials von Körperzellen bevorzugen.
Seine Bedeutung ist auch in Bezug auf die Zellen erkennbar.
Diese ionischen Bewegungen sind dank des Betriebs von Na+/K+-Pumpen möglich, die zur Herstellung chemischer Gradienten beitragen, die die beteiligten Ionen bewegen.
Ohne diese Pumpen, die in entgegengesetzter Richtung arbeiten, würden die Konzentrationsgradienten dieser Ionen auflösen und die exzitatorische Aktivität verschwinden.
In Nierenfunktion
Ein weiterer Aspekt, der die extreme Bedeutung von Natrium-Potium-Bomben hervorhebt.
Die Nierenfunktion impliziert die tägliche Filtration von mehr oder weniger 180 Litern Plasma und großen Mengen an Substanzen, von denen einige ausgeschieden werden müssen, aber viele müssen reabsorbiert werden, damit sie nicht im Urin verloren gehen.
Die Resorption von Natrium, Wasser und vielen der gefilterten Substanzen hängt von diesen Pumpen ab, die sich in der basolateralen Membran der Zellen befinden, aus denen die Epithelien der verschiedenen röhrenförmigen Segmente der Nierennephronen besteht.
Die Epithelzellen, die die Nieren -Tubuli umstimmten.
Das Wasser und die Substanzen, die reabsorb sind.
Die Reabsorption von Na+ ist sowohl in Bezug auf ihn als auch in Bezug auf die von Wasser und der anderen Substanzen, die von seinem abhängen. Der apikale Eintritt von Na+ Die Zelle erfordert, dass es einen Gradienten gibt, der ihn bewegt und eine sehr geringe Konzentration des Ions in der Zelle impliziert.
Diese niedrige intrazelluläre Konzentration von Na+ wird durch Natriumpumpen aus der basolateralen Membran erzeugt, die intensiv dazu dienen, das Ion aus den Zellen zum Interstitium zu entfernen.
Verweise
- Ganong WF: Die allgemeine und zelluläre Grundlage der medizinischen Physiologie, in: Überprüfung der medizinischen Physiologie, 25. ed. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JI: Substanztransport über die Zellmembran, in: Lehrbuch der medizinischen Physiologie, 13. ED, AC Guyton, Je Hall (Hrsg.). Philadelphia, Elsevier Inc., 2016.
- Lodisch H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J: Transport über die Zellenmembranen, in: Molecular and Cell Biology, 4. Aufl.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger Prinzipien der Biochemie. Macmillan.
- Alberts, geb., Bray, d., Hopkin, k., Johnson, a. D., Lewis, J., Raff, m.,… & Walter, P. (2013). Essentielle Zellbiologie. Garlandwissenschaft.
- « Soma Eigenschaften Teile und Funktionen
- Merkmale von Mayates (Cotinis mutabilis), Lebensraum, Reproduktion »

