Natriumborhydrid (NABH4) -Struktur, Eigenschaften, verwendet

- 2629
- 177
- Timo Rabenstein
Er Natriumbor Es ist ein anorganischer Feststoff, dessen chemische Formel NABH ist4. Es kann als repräsentativ für alkalische Borohydruros angesehen werden und ist das häufigste von diesen. Es ist ein kristalliner weißer Feststoff.
Nach dem Kontakt mit Wasser das NABH4 kann Wärme und Wasserstoff H erzeugen H2 Welches ist Kraftstoff, also muss er mit Vorsicht behandelt werden. Für die Leichtigkeit, mit der es Hydridionen erzeugen kann h-, Natriumbor ist eine mäßig reduzierende Verbindung, daher wird sie für diesen Zweck häufig bei chemischen Reaktionen verwendet.
 Natriumborhydrid, NABH4, solide. Ondřej Manggl [Public Domain]. Quelle: Wikimedia Commons.
Natriumborhydrid, NABH4, solide. Ondřej Manggl [Public Domain]. Quelle: Wikimedia Commons. Die reduzierende Eigenschaft wird auch in der Papierindustrie verwendet, da sie die Merkmale der Helligkeit und Stabilität des Zellstoffs und des Papiers verbessert, wenn sie gegen die Oxidation von Cellulose, Hauptkomponente des Papiers.
Da es in Gegenwart von Wasser leicht Wasserstoff bilden kann, wurde auch die Möglichkeit untersucht, sie als reversible Wasserstoffquelle in Brennstoffzellen zu verwenden.
Es hat andere Verwendungszwecke, die alle auf seiner reduzierenden Eigenschaft basieren, z. B. in der Pharmaindustrie.
[TOC]
Struktur
Natriumbor ist eine ionische Verbindung. Es wird durch Borhydrid -Anion [BH gebildet4]- zusammen mit dem Natrium na -kation+.
Der Anion [BH4]- Es ist tetraedrisch.
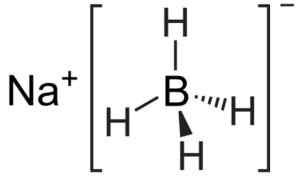 Natriumborhydridstruktur. Kemikungen [Public Domain]. Quelle: Wikimedia Commons.
Natriumborhydridstruktur. Kemikungen [Public Domain]. Quelle: Wikimedia Commons. Die Lewis -Struktur lautet wie folgt:
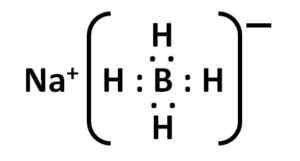 NABH Lewis Elektronische Struktur4. Autor: Marilú Stea.
NABH Lewis Elektronische Struktur4. Autor: Marilú Stea. Nomenklatur
-Natriumbor
-Natriumtetrahydroat
-Natriumtetrahydrurorat
Physikalische Eigenschaften
Körperlicher Status
Kristalliner weißer Feststoff.
Molekulargewicht
37,84 g/mol
Selbstdirektionstemperatur
∼ 220 ºC
Zersetzungstemperatur
> 250 ºC
Dichte
1.074 g/cm3 bei 20 ºC
Kann Ihnen dienen: Grignard -Reagenz: Vorbereitung, Anwendungen, BeispieleLöslichkeit
Der nabh4 Es ist ziemlich löslich in Wasser (55 g/100 ml bei 25 ° C), wo teilweise hydrolysiert. Es ist löslich in Tetrahydrofurano (THF) und im Dietyl -Ether unlöslich.
Chemische Eigenschaften
Natriumbor wird in Wasser gelöst, wo es eine anfängliche Zersetzung oder Hydrolyse erleidet, die die Lösung grundlegend macht, die nachfolgende Hydrolyse verhindert.
[BH4]- + H2O → B (OH)3 + H2↑ + oh-
Dies wird erklärt, weil [BH4]- interagieren mit h+ Von Wasser, wo h+ Ein Hydrid -H -Anion nehmen- Zu bilden h2. Es kann gesagt werden, dass der BH3 konkurriert mit h+ Für das Hydrid h-.
In der sauren mittleren Hydrolyse ist aufgrund der Fülle von H -Ionen vollständig+.
Der nabh4 Es ist stabil in trockener Luft. Es ist nicht volatil.
Aufgrund seines Hydridionengehalts ist Natriumbor eine reduzierende Verbindung. Es ermöglicht die Reduzierung der Carbonylgruppe C = O A C-OH, dh Carbonylverbindungen für Alkohole.
Der nabh4 Allein reduziert es keine Doppelbindungen C = C, nicht einmal die Konjugate mit Carbonylgruppen -c = C -C (= O)-.
Wenn Sie jedoch mit Protonsäuren (wie HCl) oder Lewis -Säuren (wie BCL in Kontakt kommen3 oder Alcl3) Diborano B wird gebildet2H6. Und wenn diese Reaktion in Gegenwart organischer Verbindungen mit Doppelbindungen C = C der Diborano B durchgeführt wird2H6 Führt den Hydrobacion von diesen durch.
In Gegenwart geeigneter Katalysatoren und spezifischer Bedingungen können Natriumbor verschiedene Arten von funktionellen Gruppen reduzieren.
Risiken
Die Wärme der Hydrolysereaktion in Wasser reicht aus, um den darin gebildeten Wasserstoff einzuschalten. Es ist also wichtig, vorsichtig zu sein, wenn Sie es manipulieren.
Der nabh4 Es ist leicht eingeschaltet und ist leicht zu verbrennen.
Erhalten
Die typische NABH -Präparationsreaktion4 Es ist durch Natriumhydrid Nah und B (Och3)3 bei einer Temperatur von ca. 250 ° C:
Es kann Ihnen dienen: Wasserelektrolyse4 Nah + B (Och3)3 → nabh4 + 3 Naoch3
Anwendungen
Bei chemischen Reaktionen der Reduktion
Als eine Quelle von Ehren H-, Der nabh4 Es ist eine reduzierende Verbindung und wird verwendet, um andere chemische Verbindungen herzustellen. Dazu wird es in apratotischen polaren Lösungsmitteln verwendet, dh ohne H -Protonen+, Dimethylsulfoxid, Hexamethylphosphor und Dimethyyformamid.
Es wird als Reduktionsmittel sowohl bei organischen als auch bei anorganischen Chemiereaktionen verwendet.
Es ermöglicht es, Aldehydos auf primäre Alkohole und Ketone auf sekundäre Alkohole zu reduzieren.
Es reduziert auch Alkylhalogenide auf Kohlenwasserstoffe wie Iododan zu Dean.
Wenn es allein wirkt, wirkt sich die Reduktion nicht auf andere funktionelle Gruppen wie Ester, Carbonsäure, Nitril und Sulfon aus.
Seine Eigenschaft, Doppelbindungen C = C nicht zu reduzieren, nicht einmal die Konjugate mit Carbonylgruppen -c = C-C (= O)-ermöglicht es Ihnen, ungesättigte Alkohole -c = C-Ch-Ch-Ch-Ch-Ch-Ch-Ch-Chugate vorzubereiten2-Oh.
Um aromatische Verbindungen Nitrados auf ihre entsprechenden Aniline zu reduzieren, erfordert das Vorhandensein von Katalysatoren wie Kobaltchlorid oder Zinn. Disulfide auf Thiolen reduzieren.
In Gegenwart geeignete Bedingungen und Katalysatoren ermöglicht es, Carboxsäuren, Ester, inmitten, Nitrilen, Imin, Epoxide und sogar Doppel- und Dreifachbindungen zu reduzieren.
In h2 In Brennstoffzellen
Der nabh4 Es kann in eine Brennstoffzelle verwandelt werden.
Der nabh4 In Gegenwart einer alkalischen Lösung von KOH oder NaOH ist sie hydrolysiert und produziert Wasserstoff H2 Dies kann als Brennstoff in einer Batteriepolymerelektrolytbrennstoff verwendet werden.
Es wurde auch als H -Material für H -Lagerung von H untersucht2 reversibel.
NABH -Nanopartikel werden synthetisiert4 und stabilisieren sich mit einem Tensid. Nach einer Behandlung mit NICL2 Es wird eine Schutzschicht oder eine Beschichtung gebildet, die die Freisetzung von H reguliert2 vollständig reversibel.
Es kann Ihnen dienen: Silbernitrat (AGNO3): Struktur, Eigenschaften, Verwendung, ToxizitätDieses neue nanometrische Material würde die Verwendung von H ermöglichen2 als sauberer und erneuerbarer Kraftstoff erzeugt.
 Vehikel, das mit Wasserstoffbrennstoffzellen arbeitet. DR. Artur Braun (Arturbraun) [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.
Vehikel, das mit Wasserstoffbrennstoffzellen arbeitet. DR. Artur Braun (Arturbraun) [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons. In der Zellstoff- und Papierindustrie
Natriumbor wird verwendet, um die Helligkeit und andere physikalische Eigenschaften von Zellstoff und Papier zu verbessern.
Der Abbau der Zellulosematrix des Papiers erfolgt durch komplexe Prozesse, die Oxidation beinhalten. Hydroxylgruppen oxidieren Carbonyl und Carboxyl, dies führt zu Papierverfärbungen und verminderten physikalischen Eigenschaften.
Bei der Behandlung des Pulps oder des Papiers mit NABH4, Dies reduziert Aldehydos und Ketone auf Gruppen -OH, ohne die Carbboxylgruppen aus Säure zu beeinflussen, was die Stabilität und Helligkeit gegenüber Werten verbessert als die Initialen.
 Der nabh4 Ermöglicht die Verbesserung der Papierhelligkeit. Autor: Rawpixel. Quelle: Pixabay.
Der nabh4 Ermöglicht die Verbesserung der Papierhelligkeit. Autor: Rawpixel. Quelle: Pixabay. In mehreren Verwendungen
Natriumbor wird zur Behandlung von Abwasser als Geschmacksunternehmen in der Lebensmittel- und Getränkeindustrie, als Beschichtungsmittel und zur Behandlung von Oberflächen bei der Herstellung von Tabak, im pharmazeutischen, Textil- und Textilindustrieleder verwendet.
Verweise
- Christian, m.L. und Aguey-Zinsou, k.-F. (2012). Core-Shell-Strategie, die zu einer hohen reversiblen Wasserstoffspeicherkapazität für NABH führt4. ACS Nano 2012, 6, 9, 7739-7751. Aus Pubs geborgen.ACS.Org.
- Nora de Souza, m.V. und Alves v., T.R. (2006). Jüngste Methoden, die durch Natriumborhydrid bei der Reduktion verschiedener Verbindungsklassen vermittelt werden. App. Organometal. Chem. 2006; 20: 798-810. Aus der Online -Bibliothek abgerufen.Wiley.com.
- Imamoto, t. (1991). Die Ermäßigung. Natriumborhydrid. Beim Verständnis der organischen Synthese. Von Scientedirect erholt.com.
- Tang, l.C. (1986) Stabilisierung des Papiers durch Natriumborhydrid -Behandlung. In historischen Textil- und Papiermaterialien. Kapitel 24. Seiten 427-441. Fortschritte in der Chemie, Band 212. Aus Pubs geborgen.ACS.Org.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Morrison, Robert Thornton; und Boyd, Robert Neilson. 1992. Organische Chemie. Prentice-Hall. ISBN 81-203-0765-8.
- ODER.S. Nationalbibliothek für Medizin. (2019). Natriumborhydrid. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung.
- « Merkmale und Beispiele des sozialen Phänomens und Beispiele
- Kobaltchlorid (COCL2 (Struktur, Nomenklatur, Eigenschaften »

