Borax -Geschichte, Struktur, Eigenschaften, Verwendungen, Synthese, Risiken

- 1357
- 346
- Ivan Pressler
Er Borax oder Natriumborat Es ist eine Konfession für eine Gruppe chemischer Verbindungen mit einer Basisformel von Na2B4ENTWEDER7. Es handelt sich.
Die Hauptverbindungen, die als Borax bezeichnet werden, sind Folgendes: Anhydro -Natriumtetraborat, Na2B4ENTWEDER7; Pentahydrat -Natriumtetraborate (NA2B4ENTWEDER7).5H2ENTWEDER; und Natriumtetraborate, Na2B4ENTWEDER7.10H2Oder, oder sein Äquivalent, das Oktahydrat -Natriumtetraborate, na2B4ENTWEDER5(OH)4.8h2ENTWEDER.
 Borax -Fragment. Quelle: Leon Hupperichs [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Borax -Fragment. Quelle: Leon Hupperichs [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Wie zu sehen ist, unterscheiden sich alle früheren Feststoffe nur in ihrem Feuchtigkeitsgrad; Einige haben mehr Wassermoleküle in ihren Kristallen als andere. Physikalisch ist Borax ähnlich wie Teile oder robuste Kreidekristalle (überlegenes Bild).
Natürlich kommt Borax in Sedimenten saisonaler Seen vor, die durch Verdunstung getrocknet sind. Borax kommt in der Türkei, den Searles Lakes (Kalifornien), in der Wüste Atacama, Chile, Bolivien, Tibet und Rumänien vor. Synthetisch können Borax -Kristalle durch einen langsamen Keimbildungsprozess erhalten werden; das heißt, in dem das Wachstum der Kristalle bevorzugt wird.
Das Natrium, wasserfreie und zerlegtes Tetraborat sind in kaltem Wasser wenig löslich; Aber seine Löslichkeit steigt mit zunehmendem Temperaturanstieg. Dann ein2B4ENTWEDER7.10H2Oder es ist sehr löslich in Ethylenglykol, mäßig löslich in Ethanol und wenig löslich in Aceton; Dies sind weniger polare Lösungsmittel als Wasser.
Borax hat zahlreiche Anwendungen, wie beispielsweise bei der Ausarbeitung von Waschmitteln und Seifen; als Verzögerung des Feuers des Zellulosematerials; in der Glasfaserproduktion; Bei der Reinigung harte Oberflächen wie Metalle, Glas und Keramik; und unter anderem bei Korrosionshemmung.
Borax irritiert nach Augen, Haut und Atemweg. Durch Einnahme kann es unter anderem Symptome, Erbrechen, Durchfall, Absacken, Verfall und Anfälle hervorrufen. Derzeit wird vermutet, dass schädliche Auswirkungen auf die menschliche Reproduktion haben können.
[TOC]
Geschichte
Die Geschichte von Borax ist verwirrend. Es wird darauf hingewiesen, dass es im Bett eines Tibet -Sees entdeckt wurde, das durch Verdunstung getrocknet wurde. Es wurde im siebten Jahrhundert Tibet in die Saudi -Arabien verlegt, nachdem die SOLED Seidenstrecke bezeichnet wurde.
Der Begriff "Borax" war nach den zahlreichen Anwendungen, die unter dem Namen 20 Maultier -Team Borax Traummax gefunden und vermarktet wurden, beliebt, die sich auf die Art und Weise bezogen, wie der Borax durch die Wüsten von Nevada und Kalifornien transportiert wurde.
Eine andere Version ihrer Entdeckung zeigt, dass die Ägypter lange Zeit für ihre Existenz gekannt hatten, indem sie sie in den Schweißnähten von Metallen durch Hitze verwendet haben. Darüber hinaus verwendeten sie es in der Medizin und im Mumifizierungsprozess. Borax wurde im dreizehnten Jahrhundert von Marco Polo nach Europa versetzt.
In der Mitte des Jahrhunderts wurden in der Magove -Wüste große Borax -Ablagerungen entdeckt, die seitdem ihre Verwendung gemeinsam machten.
Borax -Struktur
 Borax -Ionenstruktur. Quelle: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Borax -Ionenstruktur. Quelle: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Das überlegene Bild zeigt die Ionen, aus denen sich die Borax zusammensetzt, speziell einem Feststoff mit einer Kompositionsformel von Na2[B4ENTWEDER5(OH)4] · 8h2Oder (oder na2B4ENTWEDER7· 10H2ENTWEDER).
Erstens kann die Käfigstruktur des Anion festgestellt werden [B)4ENTWEDER5(OH)4]2- (Obwohl ich zwei Gruppen haben sollte-), in dem ein achteckiger Ring (vier Atome von B und vier O) zu sehen sind), wobei eine B-O-B-Brücke ihn in zwei Hälften teilt.
Kann Ihnen dienen: Alkalische Lösungen: Definition, Eigenschaften und VerwendungDieser Käfig bleibt nicht statisch, vibriert aber unterschiedliche Konformationen im Weltraum. In geringerem Maße in der Nähe der Brücke. Es kann auch festgestellt werden, dass es sehr "sauerstoffhaltig" ist; Das heißt, es hat viele Sauerstoffatome, die mit Wasserstoffbrücken mit Wassermolekülen interagieren können.
Es ist dann nicht überraschend, dass Borax -Kristalle hydratisieren und zahlreiche Hydrate erzeugen können. So für die feste na2[B4ENTWEDER5(OH)4] · 8h2Oder es gibt acht H -Moleküle2Oder mit dem Borarat -Käfig und gleichzeitig mit den Metallzentren von Na interagieren+.
Auf der Kationsseite haben Sie den wässrigen Komplex [NA (H)2ENTWEDER)4]+N, wobei der Wert von n vom Anion/Kation -Anteil abhängt. Im oberen Feststoff n = 2, also haben Sie: [Na2(H2ENTWEDER)8]2+, deren Last 2+ die Last 2- des Boraratanion neutralisiert.
Kristalle
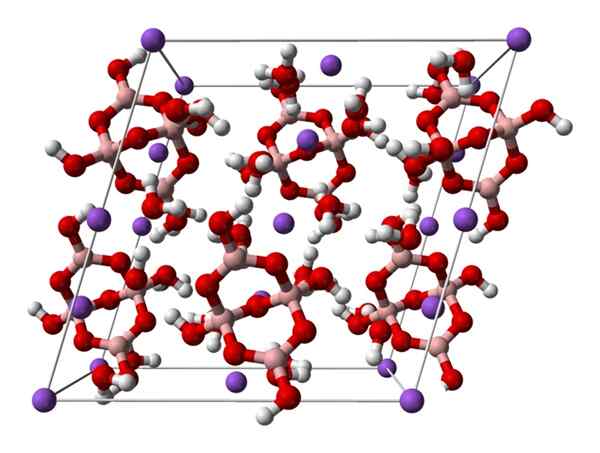 Borax -Monoklinzelle. Quelle: Ben Mills [öffentlich
Borax -Monoklinzelle. Quelle: Ben Mills [öffentlichDomain].
Hoch2[B4ENTWEDER5(OH)4] · 8h2Oder oder na2B4ENTWEDER7· 10H2ENTWEDER. Hier elektrostatische Attraktionen und Wasserstoffbrücken regeln oder dominieren die strukturellen Muster, die in jedem Glas des Glas stammen.
Andere Hydrate und wasserfreies Salz verlieren einen oder alle Wassermoleküle und verändern die Zusammensetzung und Struktur des Boraxkristalls. In allen von ihnen bleiben Anion und Kation gleich (es sei denn, es gibt Verunreinigungen oder seitliche Reaktionen), sodass Verwirrung nicht erzeugt werden kann.
Verwirrungen mit dem Boraato -Anion
N / A2[B4ENTWEDER5(OH)4] · 8h2Oder und na2B4ENTWEDER7· 10H2Oder sie sind gleich. Weil?
Erstens, wenn ihre Atome gezählt werden, werden sie sehen, dass sie in der Anzahl überfallen; Und zweitens in Anion B4ENTWEDER72- Das Fehlen der beiden OH-Gruppen, die mit den Borköpfen der B-O-B-Brücken verbunden sind, wird berücksichtigt. zwei oh das, zusammen mit den zwei h+ von b4ENTWEDER72-, addieren bis zu 2 h2Oder insgesamt 10 h2O (8 + 2).
Eigenschaften
Namen
- Borax.
- Natriumborarat.
- Natriumtetraborat.
- Tetraborates Tetraborat.
Molekulare Masse
Anhydro: 201,22 g/mol.
Decohydrat: 381,38 g/mol.
Aussehen
Ein kristalliner weißer Feststoff.
Dichte
Wasservertret: 2,4 g/cm3
Decahixure: 1.739 g/cm3
Schmelzpunkt
Anhidro: 743 ºC (1.369 ºF, 1.016 K).
Decohydrat: 75 ºC.
Siedepunkt
Anhidro: 1.575 ºC (2.867 ºF, 1.848 K).
Wasserlöslichkeit
31,78 g/l (sowohl für wasserfreies als auch für Decayroper).
Löslichkeit in organischen Lösungsmitteln
Es ist sehr löslich in Ethylenglykol, mäßig löslich in Diethylenglykol und Methanol und leicht löslich in Aceton.
Brechungsindex (ηd)
Anhidro: η1 = 1.447; η2 = 1.469.
DecayedRado: η2 = 1.472.
Stabilität
Es ist unter angemessenen Speicherbedingungen stabil. Obwohl es einen niedrigen Dampfdruck aufweist, nimmt es mit der Temperatur zu, was zu Kristallisation und Kondensation führt, sodass übermäßige Temperatur- und Feuchtigkeitsschwankungen vermieden werden sollten.
Lichtemission
Das Natriumtetraborate, wenn er der Wirkung von Feuer ausgesetzt ist, emittiert ein grünes Licht.
Reaktionen
- Beim Auflösen im Wasser stammt alkalischer Lösungen mit einem pH um 9.2 einen pH -Wert.
- Borax reagiert auf andere Borate wie Perborat (PBS).
- Es produziert auch Borsäure bei Reaktion mit Salzsäure:
N / A2B4ENTWEDER7· 10H2O + hcl => 4 h3Bo3 + 2 Na+ + 2 Cl- + 5 h2ENTWEDER
- Das Natriumtetrabat verhält sich wie eine Amphohete Substanz, da es in wässriger Lösung hydrolysiert und in der Lage ist, Säure zu neutralisieren. Auf die gleiche Weise ist es in der Lage, hohe Konzentrationsalkalien zu neutralisieren und eine übermäßige Erhöhung des mittleren pH -Werts zu vermeiden.
Kann Ihnen dienen: Primärer Alkohol: Struktur, Eigenschaften, Nomenklatur, BeispieleAnwendungen
Borax hat zahlreiche Anwendungen, sowohl im menschlichen Wesen als auch in den Aktivitäten, die es ausführt.
Antioxidantwirkung
Borax hat die Fähigkeit, Oxide aufzulösen. Aus diesem Grund wird es bei der Wiederherstellung von Metallen wie Messing, Kupfer, Blei und Zink verwendet.
Es wird auch verwendet, um die Oxidation von Metallstäben in den Fundamenten zu verhindern. Borax deckt seine Oberfläche mit Ausnahme der Luft ab und vermeidet daher Oxidation. Darüber hinaus verhindert es Korrosion von Eisenmaterial bei der Automobilherstellung.
Die Borax -Löslichkeit in Ethylenglykol war bei Frostschutzmittel nützlich. Borax neutralisiert den sauren Abfall, der während der Zersetzung von Ethylenglykol erzeugt wird, und minimiert die Oxidation, dass die Oberfläche der Metalle leiden kann.
Ausarbeitung von Klebstoffen
- Borax ist Teil einer klebenden Stärkeformulierung für Wellpapier und Karton.
- Es ist ein Peptisierungsmittel bei der Herstellung von Klebstoffen, die auf Kasein und Dextrin basieren.
- Akten stärken adhäsive Materialien durch Überqueren der konjugierten Hydroxilgruppen.
Feuerdämmend
Es wird als Feuerschutzmittel in Cellulosikermaterialien und anderen Polymeren, die Hydroxilli -Gruppen enthalten. Es übt seine Wirkung durch mehrere Mechanismen aus, einschließlich der Bildung einer Glaskörperschicht, die den Zugang von Kraftstoffen begrenzt.
Borosilisierte Glasausarbeitung (Pyrex)
Borax ist eine Borquelle, die zur Ausarbeitung von borosilisiertem Glas verwendet wird. gekennzeichnet durch einen hohen Fusionspunkt, einen niedrigen Expansionskoeffizienten und hohe Resistenz gegen thermische Schocks.
Auf diese Weise können Sie hohen Temperaturen unterliegen, ohne Frakturen zu erleben, und erhalten die feuerfeste Glasfestung.
Borosilisiertes Glas wird zur Ausarbeitung von Materialien verwendet, die zu Hause verwendet werden sollen, um Lebensmittel zu backen. Es wird auch im Labor in Becher, Fixolas verwendet, misst Zylinder, Pipetten usw.
Emulgator
Borax wird zusammen mit anderen Verbindungen verwendet, um Seifen und andere Paraffine zu emulgieren. Es wird auch als Grundlage für die Ausarbeitung von Lotionen, Cremes und Salben verwendet.
Reinigungsmittel
- Es wird in den Formulierungen hinzugefügt, um feste Oberflächen wie Metalle, Glas und Keramik zu reinigen.
- Es wird in Handreinigern, Poliermaterial und Reinigungsseifen in Wäsche und zu Hause verwendet. Darüber hinaus erleichtert es die Entfernung öliger Ablagerungen aus den Böden der Fabriken.
Medizinische Anwendungen
- Es wird bei der Behandlung von Fußpilzinfektionen verwendet.
- Es ist Teil der Nährstoffformel, die Bor versorgt. Es wird angenommen.
- Es stellt die Bestimmung von glykosyliertem Hämoglobin (Hba1c) ein, der bei einem Patienten die Entwicklung von Langzeitdiabetes dient, da die halbe Lebenszeit einer Erythrozyten 120 Tage beträgt.
Diese Informationen sind für den Arzt nützlicher als isolierte Bestimmungen des Blutzucker des Patienten.
PH -Stoßdämpfer
Es wird in mehreren pH -Stoßdämpfer verwendet, die in der Biochemie verwendet werden. Unter ihnen werden die Tris (Hydroxymethyl) Aminomethan-Boray, die bei Elektrophorese bei Polyacrylamid von DNA- und RNA-Nukleinsäuren verwendet wird.
Abnahme der Wasserhärte
Borax kann sich mit Calcium- und Magnesiumionen im Wasser kombinieren und seine Konzentration verringern. Auf diese Weise wird die Wasserhärte verringert.
Kann Ihnen dienen: Kaliumhydroxid: Struktur, Eigenschaften, verwendetDünger und Dünger
Borax wird als Borquelle verwendet. Kalzium und Bor sind an der Bildung der Zellwand der Pflanzen beteiligt. Darüber hinaus wurde darauf hingewiesen, dass Bor die Bestäubung bevorzugt, so.
Holzschutz
Borax kämpft gegen das Woodwood, einen Käfer, der das Holz verbraucht und zerstört. Es wird auch für die Erhaltung und Aufrechterhaltung von Holzschiffen verwendet.
Gründung und Fluss
Es wird als Gründer in Stahl- und Eisenschweißen verwendet, was zu einer Abnahme des Schmelzpunkts und der Eliminierung von Eisenoxid führt. Ein unerwünschter Schadstoff. Mit einem ähnlichen Ende nimmt es am Schweißen von Gold und Silber teil.
Andere
- Es wird als weiches Pestizid verwendet; Zum Beispiel für den Kampf von Motten in Wolle.
- Sprühte dient zur Kontrolle von Schädlingen, die in Schränken, Innenablagerungen, in den Wändenlücken und im Allgemeinen, in denen die Verwendung von verschmutzenden Pestiziden nicht gewünscht wird, nicht erwünscht ist.
- Es wird in Kernreaktoren verwendet, um Reaktionen zu kontrollieren, die in extremen Fällen eine Kettenreaktion erzeugen könnten.
- In Autos Heizstoffen wird Borax verwendet, um die Standorte zu erhalten, an denen Wasser entkommt.
Synthese
Borax wird durch React erhalten5ENTWEDER9.8h2Oder mit Natriumcarbonat und Natriumkohlenwasserbonat in wässrigem Medium.
Tatsächlich wird die Synthese von Natrium oder Borax -Tetraborate wenig verwendet; Der größte Teil der erzeugten Verbindung wird durch die Extraktion der Mineralien erhalten, die sie enthalten.
Der Prozess kann in einer Lösung des Erzes im Wasser zusammengefasst werden, gefolgt von einer Tonfiltration und schließlich einer Verdunstung der wässrigen Lösung.
Risiken
Borax ist ein Naturprodukt, kann jedoch eine Reihe von Gesundheitsschäden beim Menschen verursachen. Zum Beispiel kann aufgrund des Kontakts mit dem Staubstaub eine Reizung der Haut, die dermatitis verursachen kann, auftreten.
Ebenso erzeugt Borax die Augenreizungen und den oberen Atemweg. Unter den Symptomen der Inhalation gibt es Husten- und Rachenschmerzen.
In der Zwischenzeit präsentiert die Borax -Aufnahme die folgenden Symptome: Erbrechen, Übelkeit, Durchfall, Absacken, Kopfschmerzen und Anfälle. Darüber hinaus kann eine Auswirkung des Zentralnervensystems und der Nierenfunktion auftreten.
Aus Studien, die an männlichen sexuellen Ratten durchgeführt wurden und mit Borax gefüttert wurden, wurde die Hodenatrophie beobachtet. Während Studien mit schwangeren weiblichen Ratten darauf hinwiesen, dass Borax die Plazenta überqueren könnte, was zu einer Veränderung der fetalen Entwicklung führt, die sich durch niedriges Geburtsgewicht manifestiert.
Es wird angenommen, dass die Borax -Exposition die männliche Fortpflanzungsfunktion im Menschen beeinflussen kann, die sich durch eine Verringerung der Spermienzählung manifestiert.
Eine tödliche Dosis von 10 bis 25 Gramm wird für die Borax -Aufnahme bei Erwachsenen geschätzt.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Nationales Zentrum für Biotechnologie Information. (2019). Argon. Pubchem -Datenbank. CID = 23968. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Karolyn Burns, Seneca Joseph & Dr. Ryan Baumbach. (S.F.). Synthese und Eigenschaften von Boraxkristallen und intermetalllischen Legierungen. Erholt von: NationalMaglab.Org
- Wikipedia. (2019). Borax. Abgerufen von: in.Wikipedia.Org
- Rio Tinto. (2019). Borax -Dehydrat. 20 Mule Team Borax. Erholt von: Borax.com
- Fletcher Jenna. (14. Januar 2019). Ist Borax sicher zu bedienen? Erholt von: MedicalNewstody.com
- « Chromchlorid (CRCL3) -Struktur, Eigenschaften, verwendet
- Transgene Lebensmitteleigenschaften, Vorteile, Beispiele, Folgen »

