Bromo -Geschichte, Struktur, elektronische Konfiguration, Eigenschaften, verwendet

- 2290
- 38
- Nick Laurén
Er Brom Es handelt. Sein chemisches Symbol ist das Br. Es wird als Diatommolekül vorgestellt, dessen Atome durch eine kovalente Bindung vereint sind, sodass die molekulare Formel zugeordnet ist2.
Im Gegensatz zu Fluorid und Chlor ist Brom unter terrestrischen Bedingungen kein Gas, sondern eine rotbraune Flüssigkeit (niedrigeres Bild). Es raucht und zusammen mit Quecksilber, den einzigen flüssigen Elementen. Unter ihm kann das Jod, obwohl seine Farbe intensiviert und lila wird, in einem flüchtigen Feststoff kristallisieren.
 Fläschchen mit reinem flüssigem Brom. Quelle: Hi-Res-Bilder von chemischen Elementen [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]]
Fläschchen mit reinem flüssigem Brom. Quelle: Hi-Res-Bilder von chemischen Elementen [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]] Der Bromo wurde 1825 von Carl Löwig unabhängig entdeckt, der unter der Leitung des deutschen Chemikers Leopold Gmelin studierte; Und 1826 vom französischen Chemiker Antoine-Jerome Ballard. Die Veröffentlichung der experimentellen Ergebnisse von Balard ging jedoch der von Löwig voraus.
Bromo ist das 62. am häufigsten vorkommende Element der Erde und wird in niedrigen Konzentrationen durch den Kortex der Erde verteilt. Im Meer beträgt die durchschnittliche Konzentration 65 ppm. Der menschliche Körper enthält ein 0,0004 % Brom, das seine Funktion nicht definitiv kennt.
Dieses Element wird in den Salmuelas oder Orten kommerziell ausgenutzt, die durch besondere Bedingungen hohe Salze sind. Zum Beispiel das Tote Meer, zu dem das Wasser der benachbarten Gebiete mit Salzen gesättigt ist.
Es ist ein ätzendes Element, das Metalle wie Platin und Paladium angreifen kann. In Wasser gelöst, kann Brom auch seine korrosive Wirkung auf menschliche Gewebe ausüben und die Situation verschlimmern, da Bromhyterinsäure erzeugt werden kann. In Bezug auf seine Toxizität kann es zu wichtigen Schäden an Organen wie Leber, Nieren, Lungen und Magen führen.
Das Brom ist in der Atmosphäre sehr schädlich und ist 40-100-mal destruktiver für die Ozonschicht als Chlor. Die Hälfte des Verlusts der Ozonschicht in der Antarktis wird durch Reaktionen im Zusammenhang mit Bromethyl erzeugt, die als feuchtverhackt verwendet werden.
Es verfügt über zahlreiche Verwendungszwecke, wie z.
[TOC]
Geschichte
Carl Löwig Arbeit
Der Bromo wurde unabhängig und fast gleichzeitig von Carl Jacob Löwig, einem deutschen Chemiker 1825, und von Antoine Balard, einem französischen Chemiker 1826, entdeckt.
Carl Löwig, ein Schüler des deutschen Chemikers Leopold Gmelin, sammelte Wasser aus einer Frühling aus schlechten Kreuznach und fügte Chlor hinzu; Nach der Zugabe des Äthers rührte er die Mischung von Flüssigkeiten.
Dann, der durch Destillation getrennte Ether und konzentrierte es durch Verdunstung. Infolgedessen erhielt er eine rötlich -braune Substanz, die der Brom war.
Antoine Balard Arbeit
Balard dagegen benutzte Asche eines braunen Alge. Somit wurde der Bromo freigesetzt, Chlor durch das wässrige Material, das einer Extraktion unterzogen wurde, in der das Magnesiumbromid, MGBR vorhanden war2.
Anschließend wurde das Material in Gegenwart von Mangandioxid und Schwefelsäure destilliert, wodurch rote Dämpfe produziert wurden, die zu einer dunklen Flüssigkeit kondensierten. Balard fand es ein neues Element und nannte ihn Muride, abgeleitet vom lateinischen Wort Muria, mit dem die Salzlake bezeichnet wurde.
Es kann Ihnen dienen: LEBENS MATERE: Konzept, Merkmale und BeispieleEs wurde darauf hingewiesen, dass Balard den Namen Muride in Brôme geändert hat, indem Anglada oder Gay-Lussac auf der Grundlage der Tatsache, dass Brôme Pestilent bedeutet, den Geruch des entdeckten Elements definiert.
Die Ergebnisse wurden von Belard in Annales of Chemie und Physique veröffentlicht, bevor Löwig seine eigenen veröffentlichte.
Erst ab 1858 wurde Brom in wichtigen Mengen hergestellt; Jahr, in dem Stassfurt -Salzablagerungen entdeckt und ausgenutzt wurden, um Brom zu erhalten.
Elektronische Brom -Struktur und -konfiguration
Molekül
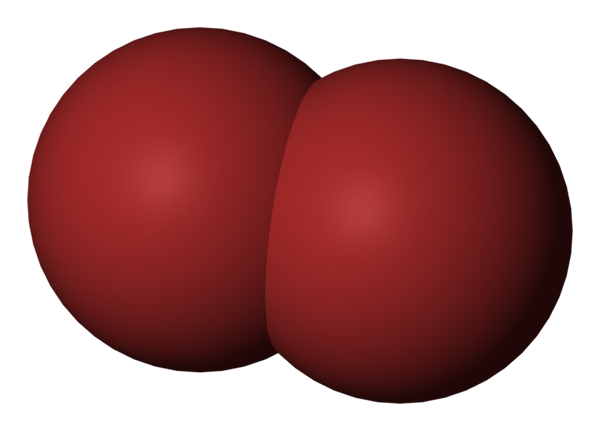 BR2 -Molekül. Quelle: Benjah-BMM27 [Public Domain].
BR2 -Molekül. Quelle: Benjah-BMM27 [Public Domain]. Im oberen Bild wird das Brommolekül gezeigt, BR2, Mit einem kompakten Füllmodell. Eigentlich gibt es eine einfache kovalente Bindung zwischen den beiden Bromatomen, Br-BR.
Da es sich um ein diatomisches und homogenes Molekül handelt, fehlt es dauerhaften Dipolmoment und kann nur durch Londoner Dispersionskräfte mit anderen des gleichen Typs interagieren.
Dies ist der Grund, warum Ihre rötliche Flüssigkeit raucht. In BR -Molekülen2, Während sie relativ schwer sind, halten ihre intermolekularen Kräfte sie schwach miteinander verbunden.
Bromo ist weniger elektronegativ als Chlor und übt daher einen geringeren Anziehungswirkung auf die Elektronen der Valencia -Schichten aus. Infolgedessen erfordert es weniger Energie, um höhere Energieniveaus zu bereisen, grüne Photonen zu absorbieren und eine rötliche Farbe zu reflektieren.
Kristalle
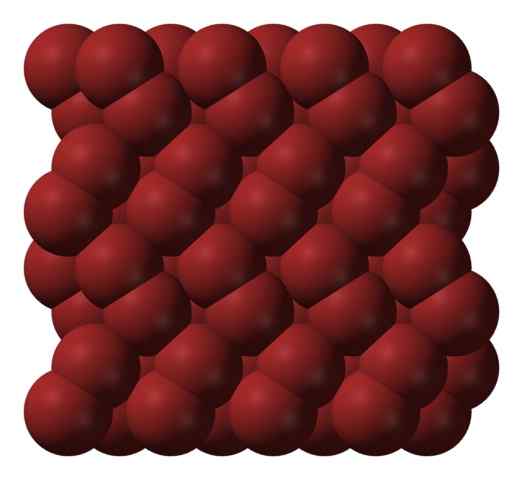 Brom -Kristallstruktur. Quelle: Ben Mills [Public Domain].
Brom -Kristallstruktur. Quelle: Ben Mills [Public Domain]. In einer Gasphase BR -Moleküle2 Sie trennen sich erheblich, bis es effiziente Wechselwirkungen zwischen ihnen gibt. Unter seinem Schmelzpunkt kann Brom jedoch in rötlichen orthorrombischen Kristallen eingefroren werden (überlegenes Bild).
Beachten Sie, wie BR -Moleküle2 Sie sind so ordentlich positioniert, dass sie "Bromwürmer" erscheinen. Hier und bei diesen Temperaturen (t < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Valencia -Schicht und Oxidationszustände
Die elektronische Bromkonfiguration lautet:
[Ar] 3d104s2 4p5
3D sein104s2 4p5 seine Valenzschicht (obwohl das 3D -Orbital10 Haben Sie keine Bedeutung in Ihren chemischen Reaktionen). Die Elektronen der 4S- und 4P -Orbitale sind die äußersten und fügen insgesamt 7 hinzu, nur ein Elektron, um das Oktett von Valencia zu vervollständigen.
Aus dieser Konfiguration können die möglichen Oxidationszustände für Brom abgeleitet werden: -1, wenn ein Elektronen erhält, um isolektronisch für den Kripton zu sein; +1, wie 3D sein104s2 4p4; +3, +4 und +5, verlieren alle Elektronen des 4p -Orbitals ([AR] 3D104s24p0); und +7, das ohne Elektronen im 4S -Orbital ([ar] 3D läuft104s04p0).
Eigenschaften
Aussehen
Kleine dunkelbraune rotes Flüssigkeit. Es ist in der Natur als Diatommolekül gefunden, mit Atomen, die durch eine kovalente Bindung vereint sind. Bromo ist eine dichtere Flüssigkeit als Wasser und sinkt hinein.
Kann Ihnen dienen: Radio: Struktur, Eigenschaften, Verwendungen, ErhaltenAtomares Gewicht
79.904 g/mol.
Ordnungszahl
35.
Geruch
Ein Hektar Rauch, erstickt und irritierend.
Schmelzpunkt
-7.2 ºC.
Siedepunkt
58,8 ºC.
Dichte (Br2) flüssig
3,1028 g/cm3
Wasserlöslichkeit
33,6 g/l a 25 ° C. Die Löslichkeit von Brom in Wasser ist niedrig und neigt tendenziell durch Abnahme der Temperatur; Verhalten ähnlich wie andere Gase.
Lösungen
Freilöslich in Alkohol, Ether, Chloroform, Kohlenstofftetrachlorid, Kohlenstoffdisulfid und konzentrierter Salzsäure. Löslich in nichtpolaren Lösungsmitteln und einigen Polar wie Alkohol, Schwefelsäure und in vielen halogenierten Lösungsmitteln.
Dreifacher Punkt
265,9 K bei 5,8 kPa.
Kritischer Punkt
588 K bei 10,34 MPa.
Fusionshitze (BR2)
10.571 kJ/mol.
Verdampfungswärme (BR2)
29,96 kJ/mol.
Molkalorienkapazität (BR2)
75,69 kJ/mol.
Dampfdruck
Bei einer Temperatur von 270 K, 10 kPa.
Self -Anmut -Temperatur
Nicht brennbar.
Zündungspunkt
113 ºC.
Lagertemperatur
2 bis 8 ºC.
Oberflächenspannung
40,9 mn/m a 25 ºC.
Riechschwelle
0,05 - 3,5 ppm. 0,39 mg/m3
Brechungsindex (ηd)
1.6083 bis 20 ° C und 1.6478 bis 25 ° C.
Elektronegativität
2.96 auf der Paulingskala.
Ionisationsenergie
- Erste Stufe: 1.139,9 kJ/mol.
- Zweite Ebene: 2.103 kJ/mol.
- Dritte Ebene: 3.470 kJ/mol.
Atomradio
120 Uhr.
Radio kovalent
120.3 Uhr.
Van der Waals Radio
185 Uhr.
Reaktivität
Es ist weniger reaktiv als Chlor, aber reaktiver als Jod. Es ist ein weniger starkes Oxidationsmittel als Chlor und stärker als Jod. Es ist auch ein schwächeres Reduktionsmittel als Jod, aber stärker als Chlor.
Chlordampf ist für viele Materialien und menschliche Gewebe sehr korrosiv. Es greift viele Metallelemente an, einschließlich Platin und Paladium; Aber es greift keine Blei, Nickel, Magnesium, Eisen, Zink und unter 300 ° C entweder zum Natrium an.
Bromo im Wasser erlebt eine Veränderung und verwandelt sich in Bromid. Es kann auch als Bromat existieren (Bruder3-)) Abhängig vom flüssigen pH -Wert.
Aufgrund seiner oxidierenden Wirkung kann Brom die Freisetzung von sauerstofffreien Radikalen induzieren. Dies sind starke Oxidationsmittel und können Gewebeschäden verursachen. Außerdem kann Brom in Kombination mit Kalium, Phosphor oder Zinn eine spontane Zündung erzeugen.
Anwendungen
Benzinzusatz
Ethylendibromid wurde verwendet, um mögliche Bleiablagerungen in Automotoren zu beseitigen. Nach der Verbrennung von Benzin, das Blei als Additiv verwendete, wurde das Brom in Kombination mit Blei zu Bleibromid, einem flüchtigen Gas, das durch das Abgabrohr ausgeschlossen wurde.
Während das Brom den Vorsprung aus Benzin eliminierte, war seine zerstörerische Wirkung auf die Ozonschicht sehr stark, weshalb es für diese Anwendung verworfen wurde.
Pestizide
Methylen oder Bromethylbromid wurde als Pestizid verwendet, um Böden zu reinigen, insbesondere zur Beseitigung parasitärer Nematoden wie Anylostome.
Die Verwendung der meisten Verbindungen, die Brom enthalten.
Quecksilberausgabekontrolle
Bromo wird in einigen Pflanzen verwendet, um die Quecksilberemission zu verringern, sehr giftiges Metall.
Kann Ihnen dienen: Gravimetrie: Gravimetrische Analyse, Methoden, Verwendungen und BeispieleFotografie
Silberbromid wird zusätzlich zu Silber -Yoduro und Silberchlorid als lichtempfindliche Verbindung in fotografischen Emulsionen verwendet.
Therapeutische Handlungen
Kaliumbromid sowie Lithiumbromid wurden im 19. Jahrhundert und zu Beginn des 20. Jahrhunderts als allgemeine Beruhigungsmittel eingesetzt. In einigen Ländern wie Antikonvulsionen werden immer noch einfache Salze verwendet.
Die FDA der Vereinigten Staaten billigt jedoch nicht die Verwendung von Brom für die Behandlung von Krankheiten heute nicht.
Feuerwehrer
Das Brom wird durch die Flammen in Bromhorsäure umgewandelt, was die Oxidationsreaktion stört, die während des Feuers auftritt, und das Aussterben erzeugt. Polymere enthalten Brom werden verwendet, um Brandverzögerungsharze zu machen.
Lebensmittelzusatz
Kaliumbromatspuren zum Mehl wurden hinzugefügt, um das Kochen zu verbessern.
Chemische Reagenzien und Vermittler
Wasserstoffbromid wird als Reduktionsmittel und Katalysator für organische Reaktionen verwendet. Bromo wird als chemischer Vermittler bei der Herstellung von Arzneimitteln, Hydraulikflüssigkeiten, Kältemitteln, Entfeuchtierern und in Vorbereitungen zum Wellen des Haares verwendet.
Es wird auch bei der Ausarbeitung von Brunnenbohrflüssigkeiten, Produkten zur Wasserdesinfektion, weißlichen Wirkstoffen, Oberflächen -Desinfektionsmitteln, Farbstoffen, Kraftstoffzusatzstoffen usw. verwendet.
Biologische Wirkung
Eine im Jahr 2014 durchgeführte Studie zeigt, dass Brom ein notwendiger Cofaktor für die Biosynthese von Kollagen IV ist, was Brom zu einem wesentlichen Element für die Entwicklung von Tiergewebe macht. Es gibt jedoch keine Informationen über die Folgen eines Defizits des Elements.
Wo befindet es sich
Bromo wird kommerziell aus Salzminen und tiefen Salmuelas Wells im Bundesstaat Arkansas und im großen salzigen See von Utah, beide in den USA. Diese letzte Sole hat eine Bromkonzentration von 0,5 %.
Brom extrahieren.
Das Tote Meer an der Grenze zwischen Jordanien und Israel ist ein geschlossenes Meer, das sich unter dem Meeresspiegel befindet, was es zu einer sehr hohen Salzkonzentration macht.
Bromo und Calassa werden dort kommerziell durch Verdunstung von Wasser mit einem hohen Salz des Toten Meeres erhalten. In diesem Meer kann die Bromkonzentration 5 g/l erreichen.
Es kommt auch in hohen Konzentrationen in einigen heißen Federn vor. Der Bominita zum Beispiel ist ein Silberbromid -Mineral, das in Bolivien und Mexiko vorkommt.
Risiken
Das Brom im flüssigen Zustand ist für menschliche Gewebe ätzend. Aber die größte Gefahr für den Menschen kommt von Bromdämpfern und Inhalation.
In einer Umgebung mit einer Bromkonzentration von 11-23 mg/m einatmen3 Es erzeugt schwerwiegende Schocks. Eine Konzentration von 30-60 mg/m3 Es ist äußerst schädlich. Inzwischen kann eine Konzentration von 200 mg tödlich sein.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Nationales Zentrum für Biotechnologie Information. (2019). Brom. Pubchem -Datenbank. CID = 23968. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Ross Rachel. (8. Februar 2017). Fakten über Brom. Erholt von: Livescience.com
- Wikipedia. (2019). Borax. Abgerufen von: in.Wikipedia.Org
- Lentech b. V. (2019). Brom. Erholt von: lentech.com
- « Myosineigenschaften, Struktur, Typen und Funktionen
- Nukleaseigenschaften, Struktur, Typen und Funktionen »

