Kaliumbromid (KBR) Struktur, Eigenschaften, verwendet
- 3028
- 901
- René Riediger
Er Kaliumbromid Es ist ein anorganisches Salz, dessen chemische Formel KBR ist. Es wird durch die elektrostatische Vereinigung eines Bromidanions, Br, gebildet-, Und ein Kaliumkation, k+, in einem 1: 1 -Verhältnis; Das heißt, wir haben die gleiche Menge an BR- Ab k+ In KBR -Kristallen.
Kaliumbromid ist ein festes weißes oder kristallines Salz, es ist geruchlos, sehr löslich in Wasser und wenig löslich in Ethanol und Ethanol. Es wurde im letzten Teil des 19. Jahrhunderts und in einem Großteil des 20. Jahrhunderts bei der Behandlung von Epilepsie und als Beruhigungsmittel verwendet.
Bis 1975 verkaufte es sich weiterhin frei, das Jahr, in dem seine Verwendung aufgrund der toxischen Wirkungen, die es auf Patienten erzeugt hat, abnahm. Derzeit wird es immer noch bei mehreren Tierarten bei der Behandlung von Anfällen verwendet, obwohl es ab 1912 durch Natriumphenobarbital ersetzt wurde.
Kaliumbromid wird in optischen Studien verwendet, die der nahe gelegenen Infrarotregion des elektromagnetischen Spektrums entsprechen. Es dient auch als Material, das im Bereich der Fotografie verwendet wird.
[TOC]
Verbindungsart
Kaliumbromid ist ein binäres Salz, Produkt der Kombination eines Bromatoms mit einem Oxidationszustand -1 mit einem Kaliumatom mit einem Oxidationszustand +1. Daher wird eine elektrische Anziehungskraft zwischen dem Ion BR festgelegt- Und der K Ion+.
Diese Art von elektrischer oder elektrostatischer Wechselwirkung ist als ionische Bindung bekannt, die sich dissoziiert, wenn sich Kaliumbromidsalz im Wasser löst und die K -Ionen freigibt+ und Br-.
Diese Ionen werden von Wasserbesitzern aufgelöst.
Kaliumbromidstruktur
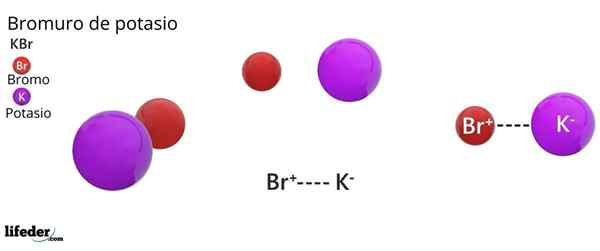
 Kristallstruktur FCC des KBR: Die braunen Kugeln entsprechen der Br-, während die violetten Kugeln den Kationen k entsprechen+
Kristallstruktur FCC des KBR: Die braunen Kugeln entsprechen der Br-, während die violetten Kugeln den Kationen k entsprechen+ Kaliumbromid zeigt eine kubische kristalline Struktur, die auf dem Gesicht zentriert ist (FCC) Gesichtszählerkubik), gleich dem, das bei Natriumchlorid beobachtet wurde.
Kann Ihnen dienen: Faraday konstantIn dieser Struktur jeder Anion BR- Es ist mit sechs K -Kationen verknüpft oder koordiniert+, Und wiederum jedes k+ Es hat sechs Br- Als Nachbarn in kristallinen Netzwerken.
Nomenklatur
Kaliumbromid wird als Halogenid- oder Alkal -Metallhalogenid eingestuft. Die Namen dieser Salze werden konstruiert, indem der letzte Buchstabe des Halogennamens (Chlor, Brom, Jod, Fluor und Astato) mit Ausnahme des Fluorids beseitigt wird und den letzten Buchstaben durch das Suffix -URO ersetzt wird. Der Name des Metalls ist unten ohne Änderung geschrieben.
Zum Beispiel: Natriumchlorid, Kaliumiodid, Calciumfluorid usw. Deshalb wird der KBR als Kaliumbromid oder Kaliumbromid bezeichnet (nach der traditionellen Nomenklatur).
Kaliumbromideigenschaften
 Uhrscheibe mit KBR -Granulat. Quelle: Walkerma über Wikipedia.
Uhrscheibe mit KBR -Granulat. Quelle: Walkerma über Wikipedia. Aussehen
Farbloses Glas, kristallines oder weißes Granulat.
Geruch
Toilette
Geschmack
Bei hoher Konzentration hat es einen bitteren und würzigen Geschmack.
Molmasse
119.02 g/mol
Dichte
2.74 g/cm3 bei 25 ºC
Schmelzpunkt
734 ºC
Siedepunkt
1435 ºC
Wasserlöslichkeit
535 g/l a 0 ºC
678 g/l a 25 ºC
1020 g/l a 100 ºC
1 Gramm des Salzes wird in 1 ml kochendes Wasser gelöst, was darauf hinweist, dass es in Wasser sehr löslich ist.
Löslichkeit in Glycerin
217 g/l
1 Gramm Kaliumbromid löst sich in 4 auf.6 ml Glycerin.
Ethanollöslichkeit
47.6 g/l a 80 ° C.
1 Gramm Kaliumbromid löst sich in 250 ml Ethanol auf.
Wasserdampfdichte
7.14 in der Luftbeziehung als Einheit genommen.
Stabilität
Stabil, wenn unter den empfohlenen Bedingungen gespeichert werden. Mit Oxidationsmitteln, starken Säuren, Brom -Trifluorid und Brom inkompatibel.
Zersetzung
Wenn er erhitzt wird, emittiert schädliche Produkte wie Wasserstoffbromid und Kaliumoxid.
Kann Ihnen dienen: Kernel Electronic Configuration: Konstruktion, BeispieleBrechungsindex (ND)
1.559
pH
In wässriger Lösung erzeugt einen neutralen pH -Wert um 7.
Zündungspunkt
1435 ºC
Auflösung und Reaktivität
In wässriger Lösung wird der KBR vollständig dissoziiert, um eine neutrale pH -Lösung zu verursachen.
Salz ist eine Bromidquelle, die für die Silberbromidproduktion, AGBR, verwendet werden kann, die für die Entwicklung von Fotografien verwendet wird:
KBR (AC) +Agno3 (AC) → Agbr (s) +Kno3 (Ac)
Außerdem ist der KBR ein schwacher Reduktionsmittel, der mit Quecksilber- und Silbersalzen unvereinbar ist. Erzeugt eine heftige Reaktion mit Brom -Trifluorid. Kann mit vielen Salzen, Alkaloiden und Stärke reagieren.
Es reagiert auch mit Säuren, zum Beispiel mit konzentrierter Schwefelsäure, wobei Wasserstoffbromid freigelassen wird.
Anwendungen
Behandlung mit Epilepsie und Anfällen
Die antikonvulsiven Eigenschaften von Kaliumbromid wurden erstmals von Sir Charles Locock auf einem Treffen der Royal Medicine and Chirurgical Society im Jahr 1857 freigelegt, das seine Verwendung bei der Behandlung von Epilepsie förderte.
Kaliumbromid wurde als Prioritätsmedikament bei der Behandlung von Epilepsie und als Beruhigungsmittel bis 1912 verwendet, als das Natriumphenobarbital angekündigt wurde.
Trotzdem wurde es weiterhin als Ergänzung zum Natriumphenobarbital bei der Behandlung von Epilepsie -Anfällen verwendet.
Im Jahr 1975 aufgrund seines giftigen Charakters die FDA U.S. (Food & Drug Administration) beschlossen, den Einsatz von Kaliumbromid nicht sowohl beim Menschen als auch beim Tieren zu empfehlen. Einige Länder verwalteten es jedoch weiterhin.
Kaliumbromid wurde bei Rindern, Pferden, Schafen und Schweinen als hypnotisch und beruhigend verwendet. Es wurde auch bei der Behandlung von Koliken und Tetanien bei Pferden und bei der Behandlung von Anfällen bei Hunden verwendet.
Infrarot -Optik
Aufgrund der Transparenz des Kaliumbromids in einem Bereich von Wellenlängen zwischen dem ultravioletten Licht und dem nahe.
Kann Ihnen dienen: OsmolaritätIn dieser Hinsicht werden verschiedene Techniken angewendet. Eine von ihnen besteht in der Ausarbeitung von zwei kristallinen Kaliumbromidscheiben und platziert einen Film des Materials, das im Infrarot in den Alben analysiert werden soll. Die Studien werden im Beinahe -Infrarot zwischen 780 nm und 3000 nm durchgeführt.
Fotografie
 Der KBR war Teil der Materialien, mit denen die ersten Fotos des 20. Jahrhunderts verarbeitet wurden
Der KBR war Teil der Materialien, mit denen die ersten Fotos des 20. Jahrhunderts verarbeitet wurden Kaliumbromid hatte zahlreiche Verwendungen und Anwendungen in der Fotografie, zum Beispiel: Es wurde verwendet, um Fotografieentwickler zu formulieren, bei der Herstellung von fotografischen Filmen, als Filmdicke und als Farbbleiche in Farbe.
Es wird bei der Verbesserung der Differenzierung zwischen den Silberhalogeniden -Kristallen verwendet und nicht ausgesetzt.
Es wurde auch in Kombination mit Quecksilberbichlorid, Kupfersulfat oder Kaliumferricianurio in fotografischen Tribünen verwendet. Es wurde auch als Limiter bei alkalischen Entwicklern gedient, die für Gelatine -Platten und Entwicklungsarbeiten verwendet wurden.
Chemische Analyse
Der KBR wird zur Bestimmung der Bewertung von Kupfer und Silber bei der polarografischen Analyse des Inders, Cadmiums und Arsen verwendet.
Andere Verwendungen
Es wird in Lithographie -Gravurprozessen, in der Ölverarbeitung, in der thermischen Stabilisierung des Nylons, bei der Herstellung von Fasern und schließlich zur Herstellung von Spezialseifen verwendet.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Tag, r., & Underwood, a. (1986). Quantitative analytische Chemie (Fünfter Aufl.). Pearson Prentice Hall.
- Wikipedia. (2020). Kaliumbromid. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologie Information. (2021). Kaliumbromid. Pubchem Comunund -Zusammenfassung für CID 253877. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- EMEA. (1999). Bromid, Kaliumsalz: Zusammenfassender Bericht. [PDF]. Erholt von: ema.Europa.EU
- Sevier b.V. (2020). Kaliumbromid. Scientedirect. Abgerufen von: Scientedirect.com

