Butanalstruktur, Eigenschaften, Verwendungen und Risiken
- 4054
- 785
- Frederike Birkemeyer
Er Butanal Es ist ein offener Aldehyd, bestehend aus vier Kohlenstoffatomen, und ist analog zum Butan; Es ist in der Tat die am zweithäufigsten oxidierte Form von Butankohlenwasserstoff nach Butschosäure. Seine molekulare Formel ist Cho3CH2CH2Cho, wo -CHO ist die Formilgruppe.
Dieser Aldehyd, einer der leichtesten, besteht aus einer transparenten, brennbaren und weniger dichten Flüssigkeit als Wasser. Darüber hinaus ist es in Wasser löslich und mit den meisten organischen Lösungsmitteln mischbar. Daher kann es verwendet werden, um eine Phasen -Phase -organische Gemische zu haben.
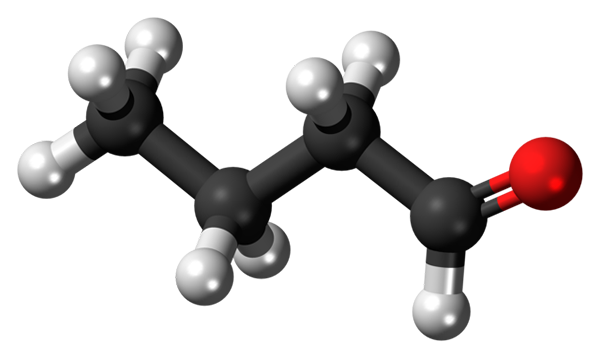
 Butanal oder Butiraldehyd -Molekül. Quelle: Jynto [CC0]
Butanal oder Butiraldehyd -Molekül. Quelle: Jynto [CC0] Das Vorhandensein der Carbonylgruppe (das der roten Kugel, überlegenes Bild) verleiht dem Butanal-Molekül eine chemische Polarität und damit die Fähigkeit, die Dipol-Dipolo-Wechselwirkung zwischen seinen Molekülen zu erleben; Obwohl zwischen ihnen keine Wasserstoffbrücken gebildet werden.
Dies bringt infolge.
Butanal wird als Lösungsmittel verwendet und ist ein Vermittler, um zahlreiche Produkte zu erhalten. wie Beschleuniger der Vulkanisierung von Gummi, Harzen, pharmazeutischen und agrochemischen Produkten.
Butanal ist eine toxische Verbindung, die Inhalation Entzündungen des oberen Atemwegs, des Bronchien- und Lungenödems verursachen kann, das sogar tödliche Konsequenzen haben kann.
[TOC]
Butanalstruktur
Es wurde gerade erwähnt, dass die Formilgruppe -ch. Infolgedessen können ihre Moleküle durch Dipol-Dipolo-Kräfte miteinander interagieren.
Kann Ihnen dienen: Rotary Trockner: Betrieb, Wofür es ist, Teile, AnwendungenIm oberen Bild wird es mit einem Modell von Kugeln und Balken gezeigt, dass das Butanal -Molekül eine lineare Struktur hat. Die Kohlenstoff -Cho der Gruppe hat SP -Hybridisierung2, während die verbleibenden Kohlenstoffe3.
Nicht nur das, es ist auch flexibel, und ihre Verbindungen können sich auf ihren eigenen Achsen drehen. Und daher werden unterschiedliche Konformationen oder Konformere erzeugt (gleiche Verbindung, jedoch mit ihren gedrehten Verbindungen).
Konformeros
Das folgende Bild erklärt diesen Punkt am besten:
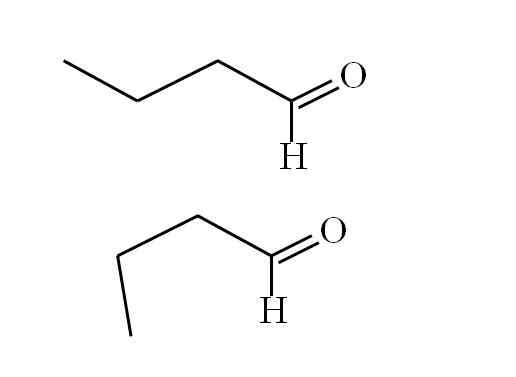 Butanal konform. Quelle: Gabriel Bolívar.
Butanal konform. Quelle: Gabriel Bolívar. Der erste Konformer (der Vorgesetzte) entspricht dem Molekül des ersten Bildes: der Methylgruppe links, -ch3, und die Gruppe -CH sind in anti -parallelen Positionen; Einer zeigt nach und der andere nach unten.
In der Zwischenzeit entspricht der zweite Konformer (der untere) dem Molekül mit dem -ch3 und das -ho in in den Schatten stehenden Positionen; Das heißt, beide zeigen in die gleiche Richtung.
Beide Konformere sind schnell austauschbar, und daher dreht sich das Butanal -Molekül und vibriert ständig; Und fügte hinzu, dass er einen dauerhaften Dipol hat, so dass seine Interaktionen stark genug sind, um bei 74,8ºC zu kochen.
Eigenschaften
Chemische Namen
-Butanal
-Butiraldehyd
-1-Butanal
-Butiral
-N-Butiraldehyd.
Molekularformel
C4H8Oder ch3CH2CH2Cho.
Aussehen
Es ist eine klare, transparente Flüssigkeit.
Geruch
Charakteristischer Geruch, Acre, Aldehyd.
Siedepunkt
167 ºF bei 760 mmHg (74,8 ºC).
Schmelzpunkt
-146 ºF (-96,86 ºC).
Zündungspunkt
-8 ºF (-22 ºC) geschlossenes Glas.
Wasserlöslichkeit
7 g/100 ml bei 25 ºC.
Löslichkeit in organischen Lösungsmitteln
Mischbar mit Ethanol, Ether, Ethylacetat, Aceton, Toluol und vielen anderen organischen Lösungsmitteln.
Dichte
0,803 g/cm3 bei 68 ºF.
Kann Ihnen dienen: Nitrate: Eigenschaften, Struktur, Nomenklatur, SchulungWasserdampfdichte
2,5 (in der Luftbeziehung gleich 1).
Dampfdruck
111 mmHg bei 25 ºC.
Selbststeuerung
446 ºF. 425 ºF (21,8 ºC).
Schmiere
0,45 CPOISE bei 20 ° C.
Verbrennungswärme
2479.34 kJ/mol bei 25 ° C.
Verdampfungswärme
33,68 kJ/mol bei 25 ° C.
Oberflächenspannung
29,9 Dina/cm a 24 ºC.
Riechschwelle
0,009 ppm.
Brechungsindex
1.3843 bis 20 ° C.
Dipolarem Moment
2.72 d.
Wellenlängen (λ) der maximalen Absorption im Wasser
225 nm und 282 nm (ultraviolettes Licht).
Polymerisation
Butanal kann in Kontakt mit Alkalien oder Säure polymerisieren und eine gefährliche Polymerisation ist.
Reaktivität
Wenn der Luft oxidiert wird und Buttersäure bildet. Bei einer Temperatur von 230 ° C ist das Butanal spontan mit der Luft entzündet.
Aldolische Kondensation
Zwei Butanal-Moleküle können in Gegenwart von KOH und einer Temperatur von 6 bis 8 ° C aufeinander reagieren, um die Verbindung 2-Ethyl-3-Hydroxyhexanol zu bilden. Dieser zusammengesetzte Typ wird als Aldol bezeichnet, da er eine Aldehydgruppe und eine alkoholische Gruppe in seiner Struktur hat.
Synthese
Butanal kann durch katalytische Dehydrierung von N-Butylalkohol auftreten; die katalytische Hydrierung des Crotonaldehyds; und Propylenhydroformilation.
Anwendungen
Industrielle
-Butanal ist ein industrielles Lösungsmittel, aber auch Vermittler in der Synthese anderer Lösungsmittel; Zum Beispiel 2-Ethylhexanol, N-Butanol und Trimethylpropan.
-Es wird auch als Vermittler bei der Ausarbeitung von synthetischen Harzen verwendet, darunter auch Butiral Polyvinil; Beschleuniger der Vulkanisierung von Gummi; Herstellung von pharmazeutischen Produkten; Produkte zum Schutz des Pflanzens; Pestizide; Antioxidantien; Brinkende Assistenten.
-Butanal wird als Rohstoff zur Ausarbeitung synthetischer Aromen verwendet. Darüber hinaus wird es als Lebensmittelgeschmacksmittel verwendet.
Es kann Ihnen dienen: Natriumbromid (NABR)Andere
-Bastanal wird beim Menschen als Biomarker verwendet.
-Es wurde experimentell zusammen mit Formalin und Gluterdehyd verwendet, um zu versuchen, die Enthärtung von Rindfleischhelmen aufgrund von Wasser, Urin und Rindern zu verringern. Die experimentellen Ergebnisse waren positiv.
Risiken
Das Butanal ist destruktiv für die Schleimgewebemembranen des oberen Atemwegs sowie für Haut- und Augengewebe.
Durch Kontakt mit der Haut erzeugt Rötungen und Verbrennungen. In den Augen werden die gleichen Läsionen erzeugt, begleitet von Schmerzen und Schäden am Augengewebe.
Butanal Inhalation kann schwerwiegende Konsequenzen haben, da sie in den Bronchials mit Larynx und Entzündungen und Ödemen produzieren kann. Während der Lunge produziert es chemische Lungenentzündung und Lungenödeme.
Die Überexpositionszeichen umfassen: Beginnsempfindungen am oberen Atemweg, Husten, Keuchen, dh bei der Atmung; Laryngitis, Atemmangel, Kopfschmerzen, Übelkeit und Erbrechen.
Inhalation kann aufgrund des Krampfes der Reparaturstraßen tödlich sein.
Butanal -Aufnahme verursacht ein Gefühl des "Verbrennens" auf Verdauungswege: Mundhöhle, Rachen, Speiseröhre und Magen.
Verweise
- Morrison, r. T. Und Boyd, r. N. (1987). Organische Chemie. (5ta Auflage.). Editorial Addison-Wesley Iberoamericana.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Pubchem. (2019). Butanal. Erholt von: Pubchem.NCBI.Nim.NIH.CHEF
- Wikipedia. (2019). Butanal. Geborgen von: ist.Wikipedia.Org
- Chemisches Buch. (2017). Butanal. Erholt von: Chemicalbook.com
- Basf. (Mai 2017). N-Butyraldehyd. [PDF]. Abgerufen von: Lösungsmittel.Basf.com
- « Primärer Kohlenstoffeigenschaften, Typen und Beispiele
- Integrale Bildungsmerkmale und wie man es erreicht »

