Butanone -Struktur, Eigenschaften und Verwendung
- 837
- 153
- Luca Holdt
Der Butanone Es ist eine organische Verbindung, insbesondere ein Keton, dessen chemische Formel Cho ist3CH2Coch3. Sein Aussehen ist das einer farblosen Flüssigkeit, die grundlegend als Lösungsmittel verwendet wird. Es hat ähnlich wie Acetoneigenschaften, aber mit höherer Temperatur kochen und verdunstet langsamer.
Es wird durch die katalytische Dehydrierung von 2-Butanol (chirale Verbindung) produziert. In der Zusammensetzung einiger Früchte ist es jedoch in natürlicher Zustand. Es ist Teil der Emanationen der Ableitungsrohre der Fahrzeuge und ein Bestandteil des Tabakrauchs.
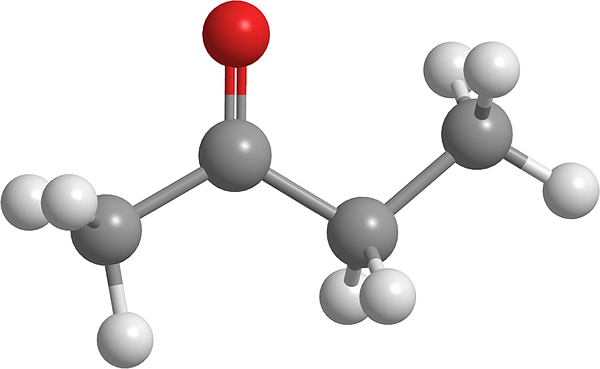
 Butanone -Molekül. Quelle: Pixabay.
Butanone -Molekül. Quelle: Pixabay. Es ist nach Aceton die einfachste dieser Familie organischer Verbindungen. Butnonone verursacht Reizungen in den Augen und in der Nase. In einer ungewöhnlich hohen Dosis kann es Lungenschleimhaut verursachen. Andererseits wird diese Flüssigkeit als Vorläuferagent der Betäubungsmittel angesehen.
Butanone hat große Löslichkeit im Wasser; Aber es ist auch sehr löslich in organischen Lösungsmitteln wie Ethanol, Ether, Aceton, Benzol und Chloroform. Dies könnte erklärt werden.
[TOC]
Butanone Struktur
Im oberen Bild wird das Butanone -Molekül mit einem Kugeln und Balkenmodell gezeigt. Das Sauerstoffatom der Carbonylgruppe (rote Kugel) ist im zweiten Kohlenstoff zu beobachten. Diese Gruppe, C = O, ist verantwortlich, dem Molekül ein dauerhaftes Dipolmoment zu verleihen.
Butanone, strukturell Ansicht, ist nichts weiter als ein Aceton, zu dem eine Methylengruppe zugesetzt wurde, CH2. Das Dipolmoment ist im Vergleich zu dem von Aceton kleiner. Aber seine größte molekulare Masse führt dazu, dass sie bei einer höheren Temperatur kochen.
In diesem Molekül fehlt wie andere Ketone die Möglichkeit, Wasserstoffbrücken zu bilden. Und daher sind ihre Dipol-Dipolo-Wechselwirkungen nicht so stark.
Kann Ihnen dienen: Emulgator: Emulsionsprozess, molekulare Aspekte, AnwendungenDeshalb ist es eine flüchtige Flüssigkeit. Wenn die Temperatur sinkt (-86,6 ° C), sind ihre schwachen Dipole diejenigen, die ihre Moleküle leiten, um einen Kristall zu bilden. Darüber hinaus kann auch kommentiert werden, dass Butanone strukturell asymmetrisch ist.
Eigenschaften
Molekularformel
C4H8Oder ch3Coch2CH3
Namen
- Butanone.
- 2-Butanon.
- Butan -2 -a.
- Methylethil Cetona.
Molmasse
72,107 g/mol.
Physische Beschreibung
Farblose Flüssigkeit.
Geruch
Duftend für Minze, mäßig stark.
Siedepunkt
79,59 ºC bei 760 mmHg.
Schmelzpunkt
-86.6 ºC.
Zündungspunkt
-9 ºC (geschlossene Tasse).
Wasserlöslichkeit
29 g /100 ml bei 20 ºC. Während sein Dipolmoment geringer ist als das von Aceton, kann es immer noch in hervorragendem Maße mit Wassermolekülen interagieren. Von ihnen erhält Wasserstoffbrücken: (CH3) (CH2CH3) C = o-hah. Aus diesem Grund ist im Wasser sehr löslich.
Löslichkeit in organischen Lösungsmitteln
Löslich in Benzol, Alkohol und Äther; Mischbar mit Ölen, Ethanol, Ether, Aceton, Benzol und Chloroform. Beachten Sie, dass Butanone in einer Vielzahl von Lösungsmitteln löslich ist.
Dichte
0,7997 g/cm3 bei 25 ºC.
Wasserdampfdichte
2,41 (in Bezug auf Wasser = 1).
Dampfdruck
90,6 mmHg bei 25 ºC.
Oktanol/Wasserpartitionskoeffizient
Log p = 0,29
Self -Anmut -Temperatur
505 ºC.
Zersetzung
Es zersetzt durch photochemische Prozesse durch Oxidation durch freies Hydroxylradikal. Wenn er erhitzt wird, um zu zerlegen, emittiert ein Hektar.
Schmiere
0,40 CPOISE bei 25 ºC.
Verbrennungswärme
2.444,1 kJ/mol bei 25 ° C.
Verdampfungswärme
31.30 kJ/mol am Siedepunkt; und 34,79 kJ/mol bei 25 ° C.
Kann Ihnen dienen: Allgemeines GasrechtOberflächenspannung
23,97 mn/m a 25 ºC.
Ionisationspotential
0,54 ev.
Riechschwelle
Niedriger Geruch: 0,735 mg/m3.
Hoher Geruch: 147,5 mg/m3.
Brechungsindex
1.788 bis 20 ° C.
Dissoziationskonstante
PKA = 14,70.
Stabilität
Stabil, aber hoch entflammbar. Unvereinbar mit Oxidationsmitteln, Basen und starken Reduktionsmitteln. Feuchtigkeit sollte vermieden werden.
Anwendungen
Lösungsmittel
Butanone wird als Lösungsmittel bei der Ausarbeitung von Oberflächenbeschichtungen, Herstellung von rauchlosen Staub, farbigen Harzenausarbeitung und bei der Eliminierung der durch Schmiermittel erzeugten Fettakkumulation verwendet.
Darüber hinaus wird es zur Ausarbeitung von: verwendet:
- Kunstleder.
- Gomas.
- Lacas.
- Lack.
- Kleber.
- Lösungsmittel.
- Lackierungen.
- Klebstoffe.
- Plastikzemente.
- Dichtungsmittel.
- Magnetbänder.
- Transparentes Papier.
- Drucktinten.
- Kosmetik und pharmazeutische Produkte.
Es wird auch als Lösungsmittel für die Deckung von Metalloberflächen, Reinigungsmittel für elektronische Geräte und Fettgewinnung verwendet. Es dient für harte Holzgewinnung und Pflanzenöl.
Es ist ein inerter Zutat bei der Ausarbeitung von Pestiziden und bei der Herstellung von Acetat- und Cellulosenitrat.
Es wird als Extraktionslösungsmittel für Lebensmittelverarbeitung und Lebensmittelzutaten verwendet. Zum Beispiel bei der Fraktionierung von Fetten und Ölen sowie im Kaffee entkoffeinierten Prozess. Es wird auch als Lösungsmittel in den in weißen Brettern verwendeten Markierungen verwendet.
Reagens
- Butanone wird als wasserlösliches Fotoiniciator verwendet.
- Es kondensiert mit dem Formaldehyd, um Isopropenil -Keton zu produzieren.
- Erleben Sie die Autokodensation für die Herstellung von Ethylamylo Cetona.
- Reagiert mit Citral, um Parfümkomponenten wie Methylpseudoionon zu erhalten.
Kann Ihnen dienen: Reaktionswärme- Es greift als Katalysator in der Hydraccin -Produktion ein.
- Zusätzlich ist es ein Vorläufer für das Methylethyl -Cetona -Peroxid, der ein Katalysator für einige Polymerisationsreaktionen ist.
Plastikzement
Butanone hat die Anwendung als Kunststoffschweißmittel mit Verwendung in der Montage von Polystyrol -Skalierungsmodellen. Butnonon löst Polystyrol auf und ermöglicht es den Kanten, sich zu verbinden, wenn eine neue Polymerisation auftritt. Dieses Verhalten hat einen Zement und nicht von Klebstoff.
Andere Verwendungen
Butanon wird als Sterilisator von Bakteriensporen in Operationsinstrumenten, Nadeln, hypodermalen Injektoren und Zahninstrumenten verwendet.
Es wird als Geschmacksmittel von Lebensmitteln in sehr niedrigen Konzentrationen verwendet. Beispielsweise beträgt die Konzentration in alkoholischen Getränken 20 ppm; in gebackenen Produkten 12,7 ppm; Das Fleisch hat ungefähr 26,5 ppm; Kaugummi, 0,63 ppm; und in Fetten und Ölen 1,0 ppm.
Und schließlich wird Butanon bei der Trennung des Apoproteins der Hämoproteingruppe in Hämoproteinen verwendet.
Verweise
- Morrison, r. T. und Boyd, r, n. (1987). Organische Chemie. 5ta Auflage. Editorial Addison-Wesley Interamerikaner.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. Amine. (10thAuflage.). Wiley Plus.
- Nationales Zentrum für Biotechnologie Information. (2019). Methylethylketon -Pubchem -Datenbank. CID = 6569. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Wikipedia. (2019). Butanone. Abgerufen von: in.Wikipedia.Org
- Royal Society of Chemistry. (2015). Butanone. Chemspider. Erholt von: Chemspider.com
- Arlem Cheprasov. (2019). Was ist Butanone?? Formel & Verwendung. Lernen. Erholt von: Studium.com
- Ben Verve. (17. Mai 2017). Butanone. Chemiewelt. Erholt von: Chemistryworld.com
- « 10 hausgemachte Formen der Wiederverwendung von Wasser
- Carbonoide Elemente, Eigenschaften und Verwendung »

