Buteno

- 5123
- 610
- Frederike Birkemeyer
 Chemische Struktur des Butene
Chemische Struktur des Butene Was ist der Buteno??
Er Buteno Es ist der Name, der eine Reihe von vier Isomeren mit chemischer Formel C erhält4H8. Sie sind Alkene oder Olefine, das heißt, sie haben eine Doppelbindung c = c in ihrer Struktur. Darüber hinaus sind sie Kohlenwasserstoffe, die in Ölablagerungen vorhanden sind oder durch thermische Risse und das Erhalten von Produkten mit niedrigerem Molekulargewicht entstehen können.
Die vier Isomere reagieren mit Sauerstofffreisetzungen und einer gelben Flamme. Sie können auch mit einem breiten Spektrum kleiner Moleküle reagieren, die ihrer Doppelbindung zugesetzt werden.
Aber was sind die Isomere des Buteno?? Im oberen Bild ist die Struktur mit weißen Kugeln (Wasserstoffe) und Schwarz (Kohlenstoffe) für das 1-Buten dargestellt. Das 1-Buten ist das einfachste Isomer von Kohlenwasserstoff C4H8.
Beachten Sie, dass es acht weiße Kugeln und vier schwarze Kugeln gibt, die der chemischen Formel übereinstimmen.
Die anderen drei Isomere sind cis und trans 2-Buten und Iso-Butene. Alle von ihnen weisen sehr ähnliche chemische Eigenschaften auf, obwohl ihre Strukturen Variationen der physikalischen Eigenschaften verursachen (Fusions- und Siedepunkte, Dichten usw.).
Auch ihre Spektren haben ähnliche Muster von Absorptionsbändern.
Umgangssprachlich wird 1-Buten als Buten genannt, obwohl sich 1-Buten nur auf ein einzelnes Isomer und keinen generischen Namen bezieht. Diese vier organischen Verbindungen sind Gase, können aber mit hohen Drücken oder Kondens verflüssigt werden.
Sie sind eine Quelle für Wärme und Energie, Reagenzien für die Synthese anderer organischer Verbindungen und vor allem für die Herstellung von künstlichem Gummi nach der Synthese der Butadien.
Physikalische und chemische Eigenschaften von Buteno
Molekulargewicht
56.106 g/mol. Dieses Gewicht ist für alle Isomere der Formel C gleich4H8.
Physische Aspekte
Es ist ein farbloses und brennbares Gas (wie die anderen Isomere) und hat einen relativ aromatischen Geruch.
Siedepunkt
Die Siedepunkte für Buteno -Isomere sind die folgenden:
1 -buten: -6º c
Cis-2-buten: 3.7. c
Trans-2-Buten: 0.96º c
2 -Methylpropen: -6.9º c
Schmelzpunkt
1 -buten: -185.3. c
Cis-2-buten: -138.9º c
Trans-2-Buten: -105.5. c
2 -Methylpropeno: -140.4. c
Löslichkeit
Buteno ist aufgrund seiner apolaren Natur im Wasser sehr unlöslich. Es löst sich jedoch perfekt in einigen Alkoholen wie Benzol, Toluol und Ether auf.
Dichte
0.577 bis 25 ° C. Daher ist es weniger dicht als das Wasser und in einem Behälter würde es sich über demselben befinden.
Reaktivität
Wie jedes Alken ist seine Doppelbindung anfällig für Hinzufügen von Molekülen oder Oxidation. Dies macht den Buten und seine Isomere reaktiv. Andererseits sind sie brennbare Substanzen, daher reagieren sie vor einem Temperaturüberschuss mit dem Sauerstoff der Luft.
Kann Ihnen dienen: Butanal: Struktur, Eigenschaften, Verwendung und RisikenChemische Struktur des Butene
Im oberen Bild wird die Struktur von 1-Buten dargestellt. Zu Ihrer linken Seite können Sie den Ort der Doppelbindung zwischen dem ersten und dem zweiten Kohlenstoff sehen.
Das Molekül hat eine lineare Struktur, obwohl der Bereich um die C = C -Verbindung aufgrund der SP -Hybridisierung flach ist2 dieser Kohlenstoffe.
Wenn das 1-Buten-Molekül in einem Winkel von 180 ° gedreht würde, hätte das gleiche Molekül keine offensichtlichen Veränderungen. Daher fehlt es die optische Aktivität.
Wie würden Ihre Moleküle interagieren?? C-H-, C- und C-C-Verbindungen sind apolare Natur, daher arbeitet keiner von ihnen bei der Bildung eines Dipolmoments zusammen.
Folglich Moleküle2= CHCH2CH3 Sie müssen durch Londoner Dispersionskräfte interagieren.
Das rechte Ende des Buten bildet sofortigen Dipol, das in kurzer Entfernung die angrenzenden Atome eines benachbarten Moleküls polarisiert. Andererseits interagiert das linke Ende der Verbindung C = C über die Wolken π über den anderen (z. B. zwei Wafer oder Blätter).
Da es vier Kohlenstoffatome gibt, die das molekulare Skelett bestehen, reichen seine Wechselwirkungen kaum aus, damit die flüssige Phase einen Siedepunkt von -6 ° C aufweist.
Konstitutionelle und geometrische Isomere
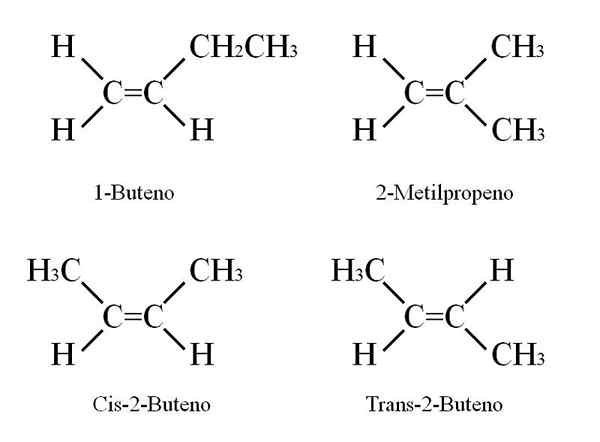 Bdr -Strukturen. Quelle: Gabriel Bolívar
Bdr -Strukturen. Quelle: Gabriel Bolívar Das 1-Buten hat eine molekulare Formel C4H8; Andere Verbindungen können jedoch in ihrer Struktur den gleichen Anteil an Atomen von C und H haben.
Wie ist es möglich? Wenn die Struktur des 1-Buten sorgfältig beobachtet wird, können Kohlenstoffe ausgesetzt werden C = C können ausgetauscht werden. Dieser Austausch erzeugt andere Verbindungen aus demselben Skelett.
Darüber hinaus kann sich die Doppelbindungsposition zwischen C-1 und C-2 in Richtung C-2 und C-3 bewegen: CH3CH = CHCH3, 2-Buten.
Im 2-Buten können H-Atome auf derselben Seite der Doppelbindung platziert werden, was der CIS-Stereoisomer entspricht. oder in einer entgegengesetzten räumlichen Ausrichtung im Transoisomer Transoisomer. Beide bilden das, was auch als geometrische Isomere bezeichnet wird. Gleiches gilt für Gruppen -ch3.
Beachten Sie ebenfalls, dass wenn Sie in Chos Molekül gelassen werden3CH = CHCH3 Die H -Atome auf einer Seite und die CH -Gruppen3 In einem anderen Fall würde ein konstitutioneller Isomer erhalten: CH2= C (ch (ch)3)2, 2-Methylpropen (auch bekannt als ISO-Butene).
Kann Ihnen dienen: Kaliumnitrat (KNO3)Diese vier Verbindungen haben die gleiche Formel C4H8 Aber verschiedene Strukturen. 1-Buten und 2-Methylpropen sind konstitutionelle Isomere; und cis und trans-2-buten, geometrische Isomere zwischen ihnen zwei (und verfassungsrechtlich in Bezug auf den Rest).
Stabilität
Verbrennungswärme
Aus dem oberen Bild, welches der vier Isomere die stabilste Struktur darstellt? Die Antwort findet sich beispielsweise in den Verbrennungswärmen von jedem von ihnen.
Bei der Reaktion mit Sauerstoff das Isomer mit der Formel C4H8 wird in co umgewandelt2 Wasser und Wärme freigeben:
C4H8(g) + 6o2(g) => 4co2(g) + 4h2O (g)
Die Verbrennung ist exotherm. Daher wird die der vier Isomere, die weniger Wärme in der Luft verbrennen, am stabilsten sein.
Die Verbrennung erwärmt sich für die vier Isomere: sind:
-1-Buten: 2717 kJ/mol
-Cis-2-buten: 2710 kJ/mol
-Trans-2-Buten: 2707 kJ/mol
-2-Methylpropeno: 2700 kJ/mol
Beachten Sie, dass das 2-Methylpropen das Isomer ist, das weniger Wärme abgibt. Während 1-Butene diejenige ist, die die meiste Wärme freigibt, was zu einer größeren Instabilität führt.
Sterischer und elektronischer Effekt
Dieser Stabilitätsunterschied zwischen Isomeren kann direkt von der chemischen Struktur abgezogen werden.
Nach Angaben der Alkene erwirbt derjenige, der den meistgesetzten Substituenten besitzt, eine stärkere Stabilisierung seiner Doppelbindung. Somit ist das 1-Buten am instabilsten, weil es kaum einen Substituenten hat (-ch2CH3); Das heißt, es ist monosustuido (rhc = cho2).
Die CIS und Trans-Isomere des 2-Butene unterscheiden sich in der Energie aufgrund der Spannung der Van der Wand, die durch den sterischen Effekt entstanden ist.
Im CIS -Isomer sind die beiden Gruppen CH3 Auf der gleichen Seite der Doppelbindung, die sie sich gegenseitig abschälen, sind diese im Trans -Isomer ausreichend voneinander entfernt.
Aber warum dann das 2-Methylpropin das stabilste Isomer ist? Weil der elektronische Effekt sich einmischt.
In diesem Fall, obwohl es sich um ein gelöstes Alken handelt, sind die beiden CH -Gruppen3 Sie sind im gleichen Kohlenstoff; in einer Geminalposition in Bezug auf die andere.
Diese Gruppen stabilisieren den Doppelbindungskohlenstoff, der ihm einen Teil ihrer elektronischen Wolke gibt (da sie durch SP -Hybridisierung relativ saurer ist2).
Darüber hinaus haben seine beiden Isomere im 2-Buten nur 2. Kohlenstoff; Während das 2-Methylpropen einen 3. Kohlenstoff enthält, ist eine größere elektronische Stabilität.
Kann Ihnen dienen: Struktur der Materialien: Konzept und BeispieleIntermolekularen Kräfte
Die Stabilität der vier Isomere folgt einer logischen Reihenfolge, aber das Gleiche geschieht nicht bei intermolekularen Kräften. Wenn ihre Schmelz- und Siedepunkte verglichen werden, werden sie feststellen, dass sie nicht der gleichen Reihenfolge befolgen.
Es ist zu erwarten, dass das Trans-2-Buten die größten intermolekularen Kräfte für einen größeren Oberflächenkontakt zwischen zwei Molekülen aufweist, im Gegensatz zu cis-2-Buten, dessen Skelett a c zieht. Cis-2-Buten kocht jedoch bei einer höheren Temperatur (3.7. c), dass das Trans Isomer (0.96º c).
Die ähnlichen Siedepunkte für 1-Buten und 2-Methylpropen würden sie erwarten, weil sie strukturell sehr ähnlich sind. Im festen Zustand ändert sich der Unterschied jedoch radikal. Das 1 -Buten schmilzt auf -185.3ºC, während das 2 -methylpropen bei -140.4. c.
Darüber hinaus schmilzt das CIS-2-Buten-Isomer auf -138.9ºC, bei einer Temperatur, die sehr nahe 2-Methylpropen ist, was bedeuten kann, dass sie bei der Festung eine ebenso stabile Anordnung haben.
Aus diesen Daten kann der Schluss gezogen werden, dass sie trotz der Kenntnis der stabilsten Strukturen nicht genug Licht in die Kenntnis bringen, wie intermolekulare Kräfte in der Flüssigkeit arbeiten. Und noch mehr in der festen Phase dieser Isomere.
Butenus verwendet
-Butenianer können angesichts ihrer Verbrennungswärme einfach als Wärme- oder Kraftstoffquelle verwendet werden. Es wäre daher zu erwarten, dass die Flamme von 1-Buten mehr mehr als die der anderen Isomere.
-Sie können als organische Lösungsmittel verwendet werden.
-Sie dienen als Zusatzstoffe, um den Oktan von Benzin zu erhöhen.
-Innerhalb der organischen Synthese beteiligt sich das 1-Buten an der Herstellung anderer Verbindungen wie: Butylenoxid, 2-Glutanol, Succinimida und Terbutilmecaptano (verwendet, um dem Küchengas seinen charakteristischen Geruch zu geben).
Auch von den Butene -Isomeren können Sie Butadieno (Cho) erhalten2= Ch-ch = ch = ch2), von denen künstlicher Gummi synthetisiert wird.
Über diese Synthese hinaus hängt die Vielfalt der Produkte davon ab, welche Moleküle zu einer Doppelbindung zugesetzt werden.
Zum Beispiel können Alkylhalogenide synthetisiert werden, wenn sie mit Halogenen reagiert werden. Alkohole, wenn sie Wasser in einem sauren Medium hinzufügen; und dritte Butleres, wenn sie Alkohole mit niedrigem Molekulargewicht (wie Methanol) hinzufügen.
Verweise
- Francis a. Schildpatt. Organische Chemie. Carboxylsäuren (Sechste Ausgabe, Seite 863-866). Mc Graw Hill.
- Wikipedia (2018). Buteno. Genommen von: Es ist.Wikipedia.Org
- Ypf (Juli). Butenianer. [PDF]. Entnommen aus: ypf.com
- William Reusch (2013). Additionsreaktionen von Alkes. Geborgen von: 2.Chemie.MSU.Edu
- Pubchem (2018). 1-Buten. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung

