Cadherinas Struktur, Eigenschaften und Funktionen
- 765
- 176
- Said Ganzmann
Der Cadherinas Sie sind transmembranale Glykoproteine, die von Kalzium abhängig sind und für die Aufrechterhaltung der Vereinigung zwischen Zellen verantwortlich sind, die es ermöglichen, die Integrität von Geweben in Tiere aufrechtzuerhalten. Es gibt mehr als 20 verschiedene Arten von Cadherinen, alle mit etwa 750 Aminosäuren, die aus verschiedenen Zellenarten angegeben sind.
Die vom Cadherin erreichten Zellgewerkschaften sind im Laufe der Zeit stabil. Daher spielen diese Moleküle eine wichtige Rolle bei der Entwicklung der Körperform während der embryonalen Entwicklung (Morphogenese) sowie bei der Aufrechterhaltung der Struktur von Geweben sowohl im embryonalen Stadium als auch im Erwachsenenleben.
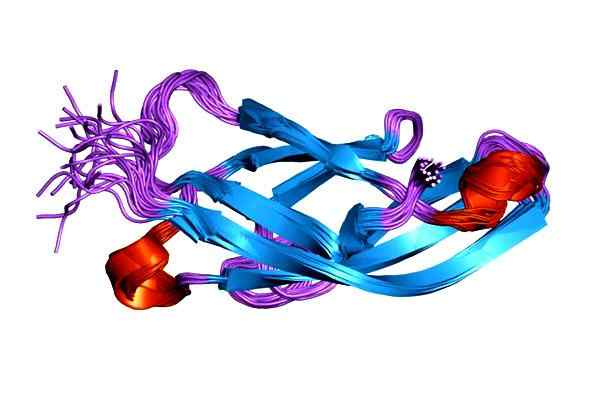
 Molekulare Darstellung des 1SUH-Proteins E-Cadherina (epithelial). Genommen und bearbeitet von: Jawahar Swaminathan und MSD -Mitarbeitern am Europäischen Bioinformatikinstitut [Public Domain].
Molekulare Darstellung des 1SUH-Proteins E-Cadherina (epithelial). Genommen und bearbeitet von: Jawahar Swaminathan und MSD -Mitarbeitern am Europäischen Bioinformatikinstitut [Public Domain]. Die Fehlfunktion des Cadherin ist mit der Entwicklung verschiedener Krebsarten verbunden. Der Mangel an Zelladhäsion durch Cadherin ist eine der Ursachen für die Zunahme der Motilität von Tumorzellen.
[TOC]
Zelluläre Adhäsionsmoleküle
In mehrzelligen Organismen müssen die Zellen an einer großen Vielfalt biologischer Prozesse teilnehmen, die die Aufrechterhaltung ihrer Integrität ermöglichen und so die kolonialen einzelligen Organismen unterscheiden. Diese Prozesse umfassen unter anderem die Hämostase, die Immunantwort, die Morphogenese und die Differenzierung.
Diese Moleküle unterscheiden sich in vier Gruppen sowohl in ihrer Struktur als auch in ihrer Funktion.
Geschichte
Die Geschichte des Cadherins ist sehr kurz, weil sie sich in letzter Zeit kennengelernt haben. So wurde die erste Cadherina 1977 in Zellen aus Mäusengeweben entdeckt. Wissenschaftler nannten dieses Uvomorulinmolekül.
In den 1980er Jahren wurde die Entdeckung vieler anderer Cadherinmoleküle in Geweben verschiedener Arten erreicht. Diese Cadherine wurden in Calcium -abhängigen Zellaggregationen -Tests gefunden. Alle von ihnen gehörten derselben Gruppe von Molekülen, die als klassische Cadherines bezeichnet werden.
Kann Ihnen dienen: ZelllyseIn den letzten Jahren und dank Fortschritten in der molekularen Biologie haben Wissenschaftler es geschafft, eine weitere wichtige Anzahl von Cadherinas zu identifizieren, von denen einige ihre spezifische Funktion unbekannt sind und diese andere Funktionen als die Zelladhäsion haben könnten.
Struktur
Cadherine sind Glykoproteine, dh Moleküle, die durch Assoziation eines Proteins und eines Kohlenhydrats gebildet werden. Sie werden zwischen 700 (im Allgemeinen 750) und 900 Aminosäuren gebildet und haben unterschiedliche funktionelle Domänen, die es zuerst ermöglichen, mit anderen Cadherinmolekülen und mit Calciumionen zu interagieren.
Funktionsdomänen erlauben auch Cadherin. Der größte Teil der Aminosäurekette befindet sich in der extrazellulären Region und unterscheidet sich normalerweise in fünf Domänen, EC (EC1 - EC5), in fünf Domänen, die genannt werden.
Jeder dieser Domänen hat ungefähr 100 Aminosäuren mit ein oder zwei Calciumgewerkschaftsstellen. Die transmembranale Region befindet sich zwischen außen und innerer Teil der Zelle und überquert die Membran einmal.
Andererseits ist der Teil der Cadherine in der Zelle sehr konservativ und besteht aus 150 Aminosäuren. Diese Domäne bindet durch zytosolische Proteine, die als Catenine bezeichnet werden.
Leute
Es gibt mehr als 20 verschiedene Arten von Cadherinen, die je nach Autoren auf unterschiedliche Weise klassifiziert werden. So erkennen beispielsweise einige Autoren zwei Gruppen oder Unterfamilien, während andere sechs erkennen. Nach ersteren können Cadherines unterteilt werden in:
Klassische Cadherines oder Typ I
Auch als traditionelle Cadherines bezeichnet. In dieser Gruppe haben die Cadherines, die gemäß dem Stoff genannt wurden, in dem sie erstmals gefunden wurden, wie E-Cadherina (Epithel), das N-Cadherin (Neural), das P-Cadherin (Plazenta), das L- Cadherina (Plazenta) sind in dieser Gruppe (Plazenta), der L-Cadherina (Leber) und R-Cadherina (Retina) enthalten. Diese Glykoproteine können jedoch in verschiedenen Geweben gefunden werden.
Kann Ihnen dienen: MesosomeZum Beispiel kann N-Cadherina nicht nur im neuronalen Gewebe vorhanden sein, sondern auch in Geweben der Hoden, Nieren, Leber und Herzmuskulatur.
Atypische Cadherinas oder Typ II
Auch nicht -traditionell oder nicht klassisch. Dazu gehören Demaglets und Democoline, die Gewerkschaften auf der Ebene interzellulärer Desmosomen bilden. Es gibt auch die Protokadherine, die durch mangelnde Verbindungen zum Actinia -Zytoskelett gekennzeichnet sind.
Alle diese Cadherina werden von einigen Autoren von anderen nicht -traditionellen in drei unabhängigen Gruppen getrennt. Der Rest der atypischen Cadherine umfasst die T-Cadherina, deren Transmembran- und zytoplasmatische Domänen fehlen, und eine Variante des E-Cadherins, die außerhalb der Zelle ist und die als Evar-Cadherina bezeichnet wird.
Eigenschaften
Sie sind calciumabhängige Glykoproteine, die fast ausschließlich in tierischen Geweben sind. Die meisten von ihnen sind Transmembrales eines einzelnen Schritts; Das heißt, dass sie in der Zellmembran vorhanden sind und sie einmal von einer Seite zu Seite überqueren.
Cadherines beteiligen sich hauptsächlich an der Vereinigung zwischen Zellen, die semi -branchierte phänotypische Eigenschaften haben (homotypische oder homophile Verbindungen). Zellgelenke, die durch diese Moleküle (Cadherin-Cadherin-Bindungen) erreicht werden, sind etwa 200-mal stärker als andere Protein-Protein-Gewerkschaften.
Im traditionellen Cadherin ist die zytoplasmatische Domäne sehr konservativ. Dies bedeutet, dass seine Zusammensetzung in der verschiedenen Cadherin ähnlich ist.
Funktionen
Die Hauptfunktion von Cadherin besteht darin, permanente zelluläre Gewerkschaften im Laufe der Zeit zu ermöglichen, daher spielen sie eine grundlegende Rolle bei Prozessen wie embryonaler Entwicklung, Morphogenese, Differenzierung und struktureller Aufrechterhaltung von Epithelgeweben in Haut und Darm sowie Axonenbildung.
Diese Funktion wird teilweise durch das terminal -CooH reguliert, der in der intrazellulären Domäne von Glykoprotein vorhanden ist. Dieses Terminal interagiert mit Molekülen, die als Catenine bezeichnet werden, was wiederum mit den Elementen des Zellzytoskeletts interagiert.
Kann Ihnen dienen: Polymorphonukleäre LeukozytenAndere Funktionen der Cadherine sind Selektivität (ausgewählt, dass eine andere Zelleinheit) und die Zellsignalisierung, die Festlegung der Zellpolarität und die Apoptose -Regulation festgelegt werden. Letzteres ist ein Mechanismus des Zelltods intern durch denselben Körper, um seine Entwicklung zu regulieren.
Cadherines und Krebs
Die Fehlfunktion der Cadherinas ist an der Entwicklung verschiedener Krebsarten beteiligt. Diese Fehlfunktion kann auf Modifikationen bei der Expression von Cadherinen und Cateninen sowie auf die Aktivierung von Signalen zurückzuführen sein, die die Vereinigung von Zellen verhindern.
Wenn die Zellvereinigung der Cadherine fehlschlägt, ermöglicht es Tumorzellen, ihre Motilität zu erhöhen und freigesetzt zu werden und dann in benachbarten Gewebe durch lymphatische Knötchen und Blutgefäße einzudringen.
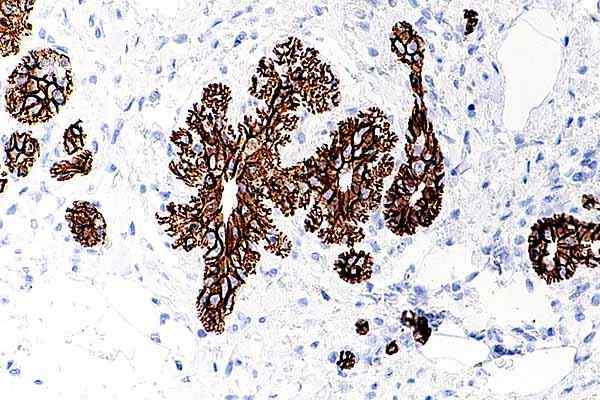 E-Cadherina Benigma de Mama. Mikroskopie der atypischen lobulären Hyperplasie. Genommen und bearbeitet von: Nephron [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]].
E-Cadherina Benigma de Mama. Mikroskopie der atypischen lobulären Hyperplasie. Genommen und bearbeitet von: Nephron [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Wenn diese Zellen die weißen Organe erreichen, dringen sie ein und vermehren sie, wobei sie invasive und metastatische Zeichen erhalten. Die meisten Arbeiten, die Cadherin mit krebserzeugenden Wachstumsprozessen in Verbindung gebracht haben.
Diese Art von Cadherina ist unter anderem an Dickdarmkrebs, Magen, Brust, Eierstöcken und Lunge beteiligt. Dies ist jedoch nicht die einzige Cadherina, die mit Krebs zusammenhängt. Die N-Cadherina spielt zum Beispiel eine Rolle bei Pleura- und Rhabdomiosarkomen-Mesoteliomen.
Verweise
- Cadherin. In Wikipedia. Abgerufen von.Wikipedia.Org
- D. Leckband & a. Prakasam (2006). Mechanismus und Dynamik der Cadherin -Adhäsion. Jährliche Überprüfung der Biomedizinischen Technik.
- F. Nolletl, p. Kools P, & f. Van Roy (2000). Die phylogenetische Analyse der Cadherin -Superfamilie ermöglicht die Identifizierung von sechs Hauptunterfamilien neben mehreren einsamen Mitgliedern. Zeitschrift für Molekulare Biologie.
- J. Günther & e. Pederera-Gastagian (2011). E-Cadherina: Schlüsselstück in der neoplastischen Transformation. Klinische Beweise und Forschungsmagazin.
- L. Petruzzelli, m. Takami & d. Humes (1999). Struktur und Funktion von Zelladhäsionsmolekülen. American Journal of Medicine.
- ODER. Cavallaro & G. Christofori (2004). Zelladhäsion und Signalübertragung durch Cadherine und Ig-Cams bei Krebs. Nature Reviews Krebs.
- « Leguaneigenschaften, Arten, Lebensraum, Reproduktion
- Formation Osteozyten, Eigenschaften und Funktionen »

