Cadmium (CD) Geschichte, Eigenschaften, Struktur, verwendet

- 4063
- 1253
- Frederike Birkemeyer
Er Cadmium (CD) ist ein Übergang oder ein post -transitionales Metall der Atomzahl 48 und Silberfarbe. Es ist formbar und duktil, mit relativ niedrigen Schmelz- und Siedepunkten. Cadmium ist ein seltenes Element und hat kaum eine Konzentration von 0,2 g / Tonne Erdkruste.
La Greenockita (CDS) ist die einzige wichtige Mena des Cadmiums, die eine intensive gelbe Färbung aufweist. Das Cadmium ist mit Zink im Sphalerit (ZNS) assoziiert, das zwischen 0,1 und 03 % Cadmium als CD -Kation enthält2+.
 Cadmiumkristalle. Quelle: Hi-Res-Bilder von chemischen Elementen [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]]
Cadmiumkristalle. Quelle: Hi-Res-Bilder von chemischen Elementen [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]] Bei der Verarbeitung des Sphannels zum Erhalten, der Gießerei und zur Verfeinerung von Zink wird Cadmium sekundär erhalten, was seine Hauptproduktionsquelle ist.
Dieses Metall wurde 1817 entdeckt, unabhängig von Friedrich Stromayer und Karl Hermann. Stromayer hat das neue Element mit dem Namen Cadmium getauft, das aus dem lateinischen Wort "Cadmia" stammt, ein Begriff als Calamin (Zinkcarbonat) war bekannt (Zinkcarbonat).
 Cadmium ist ein chemisches Element mit dem CD -Symbol und seine Atomzahl beträgt 48. Quelle: Albedo-UKR CC BY-SA 2.5 (http: // creativecommons.Org/lizenzen/by-sa/2.5/)
Cadmium ist ein chemisches Element mit dem CD -Symbol und seine Atomzahl beträgt 48. Quelle: Albedo-UKR CC BY-SA 2.5 (http: // creativecommons.Org/lizenzen/by-sa/2.5/) Cadmium ist ein Element von großem Nutzen und zahlreichen Anwendungen wie astikorrosivem Eisen, Stahl und nicht feiernden Metallen; als Pigment verwenden; PVC -Stabilisierung; Element in Legierungen, die in Schweißnähten verwendet werden; Nickel-Cadmium-Batterien wiederaufladbar usw.
Es ist jedoch ein sehr giftiges Element, das schwere Schäden an Lungen, Nieren und Knochen verursacht, und selbst eine krebserregende Wirkung wurde angegeben, weshalb seine Verwendung begrenzt war. Trotzdem wurde es in einigen Anwendungen weiterhin sorgfältig verwendet.
[TOC]
Geschichte
- Doppelentdeckung
Das Cadmium wurde 1817 von Friedrich Stromayer, einem deutschen Chemiker, in einer Zinkcarbonatprobe (Calamina) entdeckt. Im selben Jahr k. S. L. Hermann und J. C. H. Roloff machte in einem Experiment mit Zinksulfid unabhängig die gleiche Entdeckung.
Es wurde darauf hingewiesen, dass Stromayer seine Entdeckung während der Erfüllung eines staatlichen Antrags zur Inspektion der Apotheken der Stadt Hildesheim, Deutschland. Zinkoxid wurde wie jetzt bei der Behandlung bestimmter Hauterkrankungen verwendet.
Es scheint, dass Apotheken kein Zinkoxid ausgaben, sondern Zinkcarbonat: Rohmaterial für die Zinkoxidproduktion verkauft haben. Zinkoxidhersteller argumentierten, dass das Zinkcarbonat ein gelbes "Zinkoxid" erhitzt habe.
Cadmiumoxid
Sie konnten dieses "Zinkoxid" nicht verkaufen, da die Farbe der Verbindung normalerweise weiß war; Und stattdessen verkauften sie Zinkcarbonat, auch weiß. Angesichts dieser Situation beschloss Stromayer, das mutmaßliche gelbe Zinkoxid zu studieren.
Dazu erwärmte er Proben von Zinkcarbonat (Calamin) und es gab ein gelbes Zinkoxid, wie informiert. Nachdem er es analysiert hatte, kam er zu dem Schluss, dass die gelbe Farbe aufgrund des Vorhandenseins eines metallischen Oxids eines neuen Elements ein Produkt war.
Nachdem er dieses neue Metalloxid extrahiert hatte, erzeugte es seine Reduktion und erreichte eine Cadmium -Isolierung. Stromayer bestimmte seine Dichte und erhielt einen Wert von 8,75 g/cm3, in der Nähe des derzeit bekannten Werts für diesen Parameter (8,65 g/cm3).
Ebenso wies Stromayer darauf hin, dass das neue Element ein ähnliches Aussehen wie Platin hatte und dass es auch in vielen Zinkverbindungen vorhanden war und in der gereinigten Zink inklusive vorhanden war.
Stromayer schlug den Namen "Cadmium" aus der lateinischen Stimme "Cadmia" vor, der als Calamina, Znco bezeichnet wurde3.
Cadmium in Zinksulfid
Karl Hermann (1817) fand eine unhaltte gelbe Farbe, als er Zinksulfid verarbeitete und dachte, es könnte eine Kontamination mit Arsen sein. Aber als diese Möglichkeit verworfen wurde, erkannte Hermann, dass er in Gegenwart eines neuen Elements war.
- Anwendungen
1840-1940
In den 1840er Jahren wurde die Verwendung von Cadmium als Pigment ausgenutzt. Der britische pharmazeutische Codex zeigt 1907 die Verwendung von Cadmiumiodid als Medizin zur Behandlung von „vergrößerten Gelenken“, scrofulösen Drüsen und Sabañones an.
In den 1930er und 1940er Jahren war die Cadmiumproduktion zum Platin von Stahl und Eisen bestimmt, um sie vor Korrosion zu schützen. In den 1950er Jahren wurden Cadmiumverbindungen wie Cadmiumsulfid und Cadmiumselenid als rot, orange und gelbe Pigmente verwendet.
1970-1990
In den 1970er und 1980er Jahren wurde festgestellt, dass die Cadmium -Cadmium- und Stearatverbindungen PVC -Stabilisatoren waren. Umweltvorschriften aufgrund der Toxizität von Cadmium jedoch.
In den 1980er und 1990er Jahren stellte das Cadmium viele seiner Anwendungen auf, aber dann stieg seine Produktion mit der Schaffung der wiederaufladbaren Batterien von Nickel-Cadmium, die 80 % des Cadmiumverbrauchs in den USA entstanden waren.
Kann Ihnen dienen: Verwendungen und Anwendungen von AlceansPhysikalische und chemische Eigenschaften von Cadmium
Aussehen
Gefügt und weich grau -Gray weiß. Es wird brüchig, indem es 80 ° C ausgesetzt ist und mit einem Messer schneiden kann. Ist formbar und Rollen können mit ihm gebildet werden.
Standard Atomgewicht
112.414 u
Atomnummer (z)
48
Elementkategorie
Post -Übergangsmetall, abwechselnd als Übergangsmetall betrachtet. Die Definition des IUPAC eines Übergangsmetall.
Nach dieser Definition ist Cadmium seit seiner CD -Kation kein Übergangsmetall2+ Es hat seine 4D -Orbitale völlig voller Elektronen (4D10).
Geruch
Toilette
Schmelzpunkt
321.07 ºC
Siedepunkt
767 ºC
Dichte
Umgebungstemperatur: 8,65 g/cm3
Am Schmelzpunkt (Flüssigkeit): 7.996 g/cm3
Fusionshitze
6.21 kJ/mol
Verdampfungswärme
99,87 kJ/mol
Molkalorienkapazität
26.020 j/(mol · k)
Elektronegativität
1.6 auf der Paulingskala
Ionisationsenergien
Erstens: 867,8 KJ/Mol (CD+ gasförmig)
Zweitens: 1631,4 kJ/mol (CD2+ gasförmig)
Dritter: 3616 KJ/Mol (CD3+ gasförmig)
Wärmeleitfähigkeit
96,6 W/(m · k)
Widerstand Elektrisch
72,7 nω · m bei 22 ° C
Härte
2.0 auf der MOHS -Skala. Es ist ein Metall, obwohl dicht, erheblich weich.
Stabilität
Es wird langsam durch nasse Luft oxidiert, um Cadmiumoxid zu bilden, was seine metallische Helligkeit verletzt. Es ist nicht entflammbar, aber in Form von Staub kann es sich verbringen und Selbstneugung erleben.
Selbststeuerung
250 ºC für Cadmium ist eine Staubform.
Brechungsindex
1,8 bis 20 ° C
Reaktivität
Cadmium kann in der Luft verbrennen, um Cadmiumoxid (CAO) zu bilden, einen braunen amorphen Staub, während die kristalline Form dunkelrot ist.
Cadmium reagiert schnell mit verdünnter Salpetersäure und langsam mit heißer Salzsäure. Er ist auch in der Lage, mit Schwefelsäure zu reagieren, reagiert aber nicht mit Alkalien. Bei all diesen Reaktionen werden Cadmiumsalze ihrer entsprechenden Anionen gebildet (CL-) oder Oxoanionen (nein3- Und so42-).
Elektronische Struktur und Konfiguration
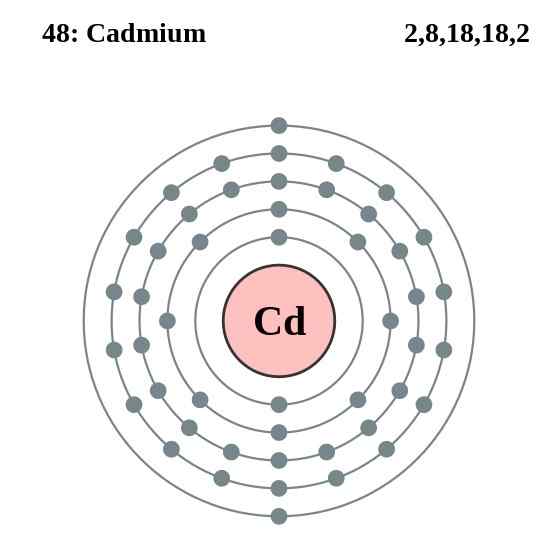 Cadmium -Elektronenschichtdiagramm, Element 48 in der Periodenzüchtertabelle. Quelle: Pumbaa (Originalarbeit von Greg Robson) CC BY-SA 2.0 (http: // creativecommons.Org/lizenzen/by-sa/2.0/)
Cadmium -Elektronenschichtdiagramm, Element 48 in der Periodenzüchtertabelle. Quelle: Pumbaa (Originalarbeit von Greg Robson) CC BY-SA 2.0 (http: // creativecommons.Org/lizenzen/by-sa/2.0/) Die Cadmium -Atome ihres Glass stellen eine Metallbindung aus ihren Valenzelektronen her, die sich in den 4D- und 5S -Orbitalen gemäß ihrer elektronischen Konfiguration befinden:
[Kr] 4d10 5s2
Obwohl die 4D -Orbitale voller Elektronen sind und dass auch angenommen werden kann, dass das „Meer der Elektronen“ reichlich zu den CD -Atomen ist, sind die Wechselwirkungen in Wirklichkeit schwach. Dies kann experimentell mit seinem niedrigen Schmelzpunkt (321 ºC) im Vergleich zu anderen Übergangsmetallen nachgewiesen werden.
Daher wird Cadmium und andere chemische Gründe manchmal nicht als Übergangsmetall angesehen. Es gibt so viele Elektronen (zwölf) an ihrer Metallbindung, die anfangen, ihre negativen Abstoßungen zu stören. Dies schwächt zusammen mit der Energiedifferenz zwischen den 4D-Orbitalen und den 5S die CD-CD-Wechselwirkung.
CD -Atome definieren am Ende eine kompakte hexagonale kristalline Struktur (HCP), die vor ihrem Schmelzpunkt keine Phasenübergänge erleidet. Wenn Cadmium -HCP -Kristalle einen Druck unterliegen, der 10 GPa entspricht, ist die Struktur nur Verformungen; Ohne jedoch eine Phasenänderung zu melden.
Oxidationszahlen
Cadmium kann die zwölf Elektronen von Valencia nicht verlieren; In der Tat können Sie nicht einmal eines seiner 4D -Orbitale verlieren, stabiler in der Energie im Vergleich zu 5S -Orbital. Daher können Sie nur die beiden Orbitalelektronen 5s verlieren2, Folglich ein trenales Metall sein; Wie bei Zink, Quecksilber und alkalischen Metallen (MR. Scholambara).
Wenn die Existenz des CD -Kation in seinen Verbindungen angenommen wird2+, Dann wird gesagt, dass Cadmium eine Oxidationszahl oder den Zustand von +2 hat. Dies ist seine Hauptoxidationszahl. Beispielsweise enthalten die folgenden Verbindungen Cadmium als +2: CDO (CD)2+ENTWEDER2-), CDCL2 (CD2+Cl2-), CDSO4 (CD2+SW42-) und CD (nein3)2.
Zusätzlich zu dieser Oxidationszahl gibt es auch +1 (CD+) und -2 (CD2-). Die Oxidationszahl +1 wird in der CD -Dikation beobachtet22+, in dem jedes Cadmium -Atom eine positive Belastung hat. In der Zwischenzeit ist -2 ziemlich seltsam und würde sich für den Anion "Cadmuro" bewerben.
Wo ist es und erhalten
 Greenockita -Kristalle. Quelle: Rob Lavinsky, Irocks.com-c-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Greenockita -Kristalle. Quelle: Rob Lavinsky, Irocks.com-c-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Cadmium ist ein seltenes Element, das eine Konzentration von 0,2 g / Tonne der Erdkruste aufweist. Das einzige wichtige Mineral von Cadmium ist Greenockita (CDS), das aus dem Bergbau und dem kommerziellen Standpunkt nicht ausgenutzt werden kann.
Kann Ihnen dienen: Flockung: Reaktion, Typen, Anwendungen, BeispieleDas Cadmium ist mit dem Zink im Spheny Mineral (ZNS) verbunden, der normalerweise eine Konzentration enthält, die zwischen 0,1 % und 0,3 % liegt; In einigen Fällen kann die Cadmiumkonzentration im Sphalerit 1,4 % erreichen.
Verarbeitete Gesteine, um Phosphordünger zu erhalten, können eine Cadmiumkonzentration von 300 mg / kg Dünger aufweisen. Kohle kann auch kleine, aber erhebliche Mengen an Cadmium enthalten.
Eine wichtige Quelle für Cadmium sind die vulkanischen Emissionen, die das Cadmium in die Oberflächengewässer bringen können. Die Verwendung von Phosphordünger in landwirtschaftlichen Gebrauchsböden hat zu einer Cadmium -Kontamination geführt.
Das in saure Böden vorhandene Cadmium ist durch Gemüse absorbierbar. Einige der Gemüse werden vom Menschen als Lebensmittel verwendet, was erklärt.
Sphaleritbehandlung
Während des Bergbaus, Schmelzen und Verfeinerung des im Sphalerit vorhandenen Zink wird Cadmium normalerweise als sekundäres Produkt erhalten. Ein ähnliches Ereignis erfolgt auch, wenn auch in geringerem Maße während Kupfer- und Bleiverarbeitung.
Ebenso können kleine Mengen Cadmium aus dem Recycling von Eisen- und Stahlabfällen erhalten werden.
Die Sprail wird einem Toast ausgesetzt, damit Zinksulfid zu seinem Oxid wird, Zno. Die gleiche Reaktion wird durch Cadmiumsulfid erlitten:
2 Zns + 3 o2 → 2 ZnO + 2 So2
Wenn diese Mischung aus Oxid mit Kohle erhitzt wird, werden sie auf ihre jeweiligen Metalle reduziert:
ZnO + Co → Zn + Co2
Ebenso können Zink und Cadmium durch Elektrolyse beim Auflösen von Oxiden in Schwefelsäure erzeugt werden.
Eine der beiden Methoden erzeugt eine fünfzig kontaminierte mit Cadmium. Beim Schmelzen kann das Cadmium aufgrund seines niedrigeren Schmelzpunkts (321 ° C) im Vakuum im Vergleich zu dem mit CINC (420 ° C) destilliert werden.
Isotope
Unter den natürlichen und stabilen Isotopen von Cadmium, die wir haben, mit ihren jeweiligen Häufigkeiten hier auf der Erde:
-106CD (1,25%)
-108CD (0.89%)
-110CD (12,47%)
-111CD (12,8%)
-112CD (24,11%)
-114CD (28,75%)
-113CD (12,23%)
Er 113CD ist radioaktiv, aber aufgrund des großen Wertes seines halben Lebens (T1/2= 7,7 · 10fünfzehn Jahre) können als stabil angesehen werden. Und dann ist da noch der 116CD, auch radioaktiv, mit einem halben Leben von 3,1 · 1019 Jahre, so kann es als stabiles Isotop angesehen werden, das 7,51 % des Cadmiums entspricht.
Beachten Sie, dass die durchschnittliche Atommasse 112.414 u beträgt, näher 112 als 114. Die Existenz eines vorherrschenden Isotops über den anderen wird im Cadmium nicht beobachtet.
Risiken
Allgemein
Cadmiumabsorption tritt hauptsächlich durch Lebensmittel auf, insbesondere durch Leber, Pilze, Schalentiere, Kakaopulver und Trockenalgen.
In China trat im letzten Jahrhundert ein emblematischer Fall auf, wo es eine wichtige Verschmutzung mit Cadmium in der Bevölkerung gab. Die Cadmiumverschmutzung war auf ihre hohe Konzentration im Reis zurückzuführen, die durch das Vorhandensein von Cadmium in Getreideanbauböden verursacht wurde.
Ein Raucher hat eine durchschnittliche Aufnahme von 60 µg / Tag. Die maximale Konzentration des im Blut erlaubten Cadmiums beträgt 15 µg / Tag. Nicht -Raucher haben eine Cadmiumkonzentration im Blut um 0,5 µg / l.
Die Lungen absorbieren zwischen 40 und 60 % des in Tabakrauchs vorhandenen Cadmiums. Das in der Lunge absorbierte Cadmium wird im Blut transportiert und bildet Komplexe mit Proteinen, Cystein und Gluta, die dann in der Leber, Nieren usw. enden.
Eine akute Cadmium -Inhalation kann Symptome verursachen, die denen ähneln, die in einem Grippeprozess beobachtet werden. wie Kälte, Fieber und Muskelschmerzen, in der Lage sein, Lungenschäden zu verursachen. In der Zwischenzeit kann eine chronische Exposition gegenüber Cadmium Lungenerkrankungen, Nieren und Knochen verursachen.
Auswirkung auf Nieren
In den Nieren führt das Cadmium normalerweise zu einer Veränderung des Phosphor- und Kalziumstoffwechsels, was durch eine Zunahme der Produktion von Nierenberechnungen zeigt. Darüber hinaus führt es zu Nierenschäden, die sich im Auftritt im Urin des Retinol-Förderers und des β-2-Mikroglobulins manifestieren.
Reproduktionseffekt
Die Mütterexposition gegenüber Cadmium ist bei der Geburt mit einem niedrigen Gewicht des Kindes und einer Erhöhung der Spontanabtreibungsrate verbunden.
Knochenschäden
Cadmium ist in Japan im letzten Jahrhundert mit dem Vorhandensein einer Itai -Iitai -Krankheit verwandt. Diese Krankheit ist durch niedrige Knochenmineralisierung, Knochenfragilität mit hoher Frakturrate, erhöhte Osteoporose und Knochenschmerzen gekennzeichnet.
Kann Ihnen dienen: CD3: Eigenschaften, FunktionenKarzinogenese
Obwohl Rattenexperimente eine Beziehung zwischen Cadmium und Prostatakrebs herstellten, wurde er beim Menschen nicht nachgewiesen. Ein Zusammenhang zwischen Cadmium und Nierenkrebs wurde nachgewiesen und wurde auch mit Lungenkrebs in Verbindung gebracht.
Anwendungen
Nickel-Cadmium-wiederaufladbare Bakterien
 Verschiedene Batterien oder Ni-CD-Batterien. Quelle: Boffy B über Wikipedia.
Verschiedene Batterien oder Ni-CD-Batterien. Quelle: Boffy B über Wikipedia. Cadmiumhydroxid wurde als Kathode in Ni-CD-Batterien verwendet. Diese wurden in der Schienen- und Luftfahrtindustrie sowie in Instrumenten für die kollektive Verwendung verwendet, darunter Mobiltelefone, Camcorder, Laptops usw.
Der Cadmiumverbrauch für die Ausarbeitung von Ni-CD-Batterien machte 80 % der Cadmiumproduktion aus. Aufgrund der Toxizität dieses Elements wurden Ni-CD-Batterien jedoch allmählich durch Nickel-Metall-Hydrid-Batterien ersetzt.
Pigmente
 Cadmium rot. Quelle: Marco Almbauer [Public Domain]
Cadmium rot. Quelle: Marco Almbauer [Public Domain] Cadmiumsulfid wird als gelbes Pigment und Cadmium seleniuro als rotes Pigment verwendet, das als Cadmio -Rot bekannt ist. Diese Pigmente zeichnen sich durch ihre Brillanz und Intensität aus, so dass sie in Kunststoffen, Keramik, Glas, Emails und künstlerischen Farben verwendet wurden.
Es wurde darauf hingewiesen, dass der Maler Vincent Van Gogh Cadmiumpigmente in seinen Gemälden verwendete, was es ihm ermöglichte, eine Vielzahl von roten, orange und hellgelben zu erreichen.
Die Färbung von Cadmiumpigmenten muss gedämpft werden, bevor sie mit Ölen gemahlen oder in Aquarellen und Acryl gemischt werden.
Fernsehen
Komponenten, die Cadmium enthielten.
Phosphor war Teil des Bildschirms, das durch Kathodenstrahlen ausgestrahlt wurde und für die Bildbildung verantwortlich war. Das Cadmium hat trotz seiner Toxizität begonnen, in den QLED -Fernsehern der jüngsten Schöpfung verwendet zu werden.
PVC -Stabilisierung
Cadmiumverbindungen, die mit Carboxylat gebildet wurden, wurden als Polyvinylchloridstabilisatoren verwendet, da sie den Abbau verzögern, der durch Wärme ausgesetzt ist, und ultraviolettes Licht, das den PVC während seines Herstellungsprozesses abbricht.
Aufgrund der Toxizität des Cadmium.
Legierungen
Cadmium wurde in Lagerlegierungen aufgrund seines hohen Resistenz gegen Müdigkeit und niedriger Reibungskoeffizient eingesetzt. Cadmium hat einen relativ niedrigen Schmelzpunkt, daher wird es in niedrigen Melzungslegierungen verwendet und ist Komponenten zusätzlich zu vielen Schweißtypen.
Cadmium kann auch in Legierungen der elektrischen Leitfähigkeit, der thermischen Leitfähigkeit und des elektrischen Kontakts verwendet werden.
Abdeckung
Cadmium wird zum Schutz von Stahl, Aluminium und anderen nicht -färtigen Metallfixierelementen sowie für mobile Teile verwendet. Cadmiumbeschichtung liefert Korrosionsschutz in diesen Kochsalzlösung und alkalischen Medien. Außerdem dient es als Schmiermittel.
Cadmium wird auch in vielen elektrischen und elektronischen Anwendungen verwendet.
Kernreaktoren
Cadmium wird in Kernreaktoren für ihre Fähigkeit zur Erfassung von Neutronen verwendet, die es ermöglicht.
Halbleiter
Die Seleniuro und Cadmium Telluriuro sind Verbindungen, die die Funktion von Halbleitern bei der Nachweis von Licht und in Solarzellen erfüllen. HGCDTE ist empfindlich gegenüber Infrarotlicht und wird als Bewegungsdetektor sowie Schalter für Fernbedienungsgeräte verwendet.
Biologie
 HE-CD-Laserlicht. Quelle: eher anonym (https: // www.Flickr.com/fotos/[E -Mail -Schutz]/35766549)
HE-CD-Laserlicht. Quelle: eher anonym (https: // www.Flickr.com/fotos/[E -Mail -Schutz]/35766549) Die Helium-CD interveniert in der Bildung eines blau-violetten Laserstrahls einer Wellenlänge, die zwischen 325 und 422 nm liegt und in Fluoreszenzmikroskopen verwendet werden kann.
Cadmium wird in der molekularen Biologie verwendet, um Kalziumkanäle zu blockieren, abhängig vom Membranpotential.
Verweise
- Wikipedia. (2019). Cadmium. Abgerufen von: in.Wikipedia.Org
- Dschungel v. R. & et al. (2014). Hochdruck- und Temperaturstruktur von flüssigem und festem CD: Auswirkungen auf die Schmelzkurve von CD. Erholt von: ResearchGate.Netz
- DR. Teig Stewart. (2019). Cadmium -Element -Fakten. Erholt von: Chemicoolool.com
- Nationales Zentrum für Biotechnologie Information. (2019). Cadmium. Pubchem -Datenbank. CID = 23973. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Godt, j., Scheidig, f., Grosse-Seestup, c., Esche, v., Brandenburg, p., Reich, a., & Groneberg, D. ZU. (2006). Die Toxizität von Cadmium und die daraus resultierenden Gefahren für die menschliche Gesundheit. Journal of Occupational Medicine and Toxicology (London, England), 1, 22. Doi: 10.1186/1745-6673-1-22
- Ros Rachel. (30. Juli 2018). Fakten über Camium. Erholt von: Livescience.com
- Die Herausgeber von Enyclopaedia Britannica. (6. September 2018). Cadmium. Encyclopædia Britannica. Erholt von: Britannica.com
- Internationale Cadmium Association. (S.F.). Cadmium -Anwendungen. Erholt von: Cadmium.Org
- Lentech b. V. (2019). Cadmium. Erholt von: lentech.com
- « Basalknoten Funktionen, Anatomie und Pathologien
- Geschichte Parasitologie, was studieren Sie??, Zweige, Konzepte »

