Calmodulinstruktur, Funktionen und Wirkungsmechanismus
- 3324
- 820
- Lewis Holzner
Calmodulin Es ist ein Begriff, der "calciummoduliertes Protein" bedeutet und sich auf ein kleines intrazelluläres Protein bezieht, das die Eigenschaft von Calciumion (Ca ++) besitzt und viele seiner intrazellulären Wirkungen vermittelt. Der Ursprung des Wortes entsteht aus der Kombination englischer Wörter 'Calcium', 'moduliert' und 'Protein' KALKCIUM ModulSchützteIn.
Unter den Mineralelementen, die Teil der Konstitution von Tierorganismen sind, unterscheidet sich Calcium, gefolgt von Phosphor, stark von den am häufigsten vorkommenden, da der Knochen durch die Ablagerung in seiner Matrix großer Mengen von Mineralsalzen gebildet wird, die daraus gebildet werden Ion.
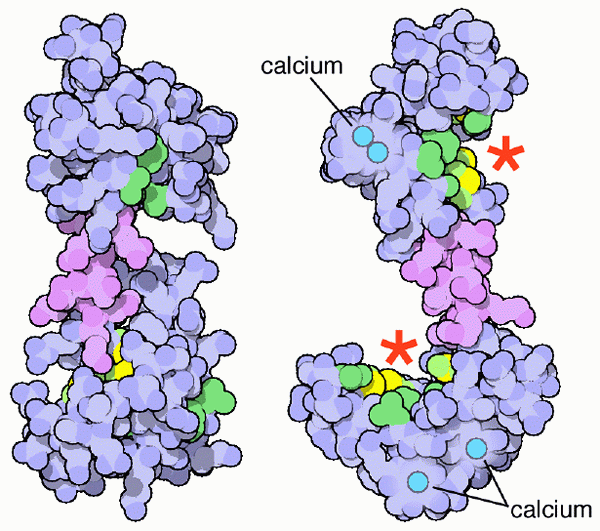
 Calmodulin-Schema und seine Calcium Union-Standorte (Quelle: PDB [CC BY-SA (https: // CreePecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Calmodulin-Schema und seine Calcium Union-Standorte (Quelle: PDB [CC BY-SA (https: // CreePecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Natürlich sind diese Calciummineralsalze für die Konstitution und Konformation des Skelettsystems von Wirbeltieren wesentlich, aber es ist die ionisierte Form von Calcium (Ca ++) in Lösung in Körperflüssigkeiten, die für die Lebensdauer der Lebensdauer relevant werden Leben der Organismen.
Dieses Kation kann mit zwei positiven elektrischen Ladungen in seiner Struktur als aktueller Förderer wirken, wenn sie sich durch die Zellmembran bewegen und sein elektrisches Potenzial in vielen der aufregenden Zellen des Körpers modifizieren, hauptsächlich im Herzmuskel.
Aber von größerer physiologischer Relevanz ist die Tatsache, dass viele zelluläre regulatorische Reaktionen, die von externen Reizen wie Neurotransmitter, Hormonen oder anderen physikalischen oder biochemischen Faktoren abgefeuert wurden Das sind Enzyme, die Enzyme sind, für die sie Kalzium zur Aktivierung oder Inaktivierung benötigen.
In diesen Fällen wird dann gesagt, dass Kalzium als zweiter Bote in einem metabolischen Wasserfall fungiert, der darauf abzielt, ein Endergebnis zu erzielen, das die notwendige Reaktion der Zellen wird, um einen Bedarf auf einer anderen Ebene als der Zelle selbst zu erfüllen, und das von ihr erfordert diese besondere Antwort.
Calcium kann direkt auf sein biochemisches Ziel einwirken, um seine Aktivität zu beeinflussen, erfordert jedoch häufig die Teilnahme eines Proteins, mit dem es sich vereint muss, um seine Wirkung auf das Protein auszuüben, um zu modifizieren. Calmodulin ist einer der vermittelnden Proteine.
[TOC]
Struktur
Calmodulin von großer Allgegenwart, da es in fast allen Zelltypen eukaryotischer Organismen exprimiert wird, ist es ein kleines Säureprotein von etwa 17 kDa -Molekulargewicht, dessen Struktur unter den Spezies extrem erhalten bleibt.
Kann Ihnen dienen: Ionische Kanäle: Struktur, Funktionen, TypenEs handelt. Jede kugelförmige Domäne hat zwei Gründe, die als EF -Hand bekannt sind (aus Englisch EF Hand) die typisch für die Proteine sind, die an Calcium binden.
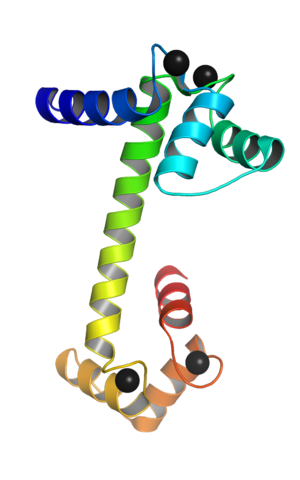 Calmodulin mit Calciumionen verbunden.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Calmodulin mit Calciumionen verbunden.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Diese „EF“ -Topologischen Motive repräsentieren eine Art SuperSecundaria -Strukturen; Sie sind in jeder kugelförmigen Domäne durch eine Region mit großer Flexibilität miteinander verbunden, und in jedem von ihnen gibt es einen Übergangsort für das Ca ++.
Die Vereinigung von Kalziumionen mit positiver Belastung ist dank des Vorhandenseins von Aminosäureabfällen mit lateralen Ketten, die in den Calcium Union -Stellen des Calmodulin Calcium negativ geladen sind, möglich. Dieser Abfall ist drei Aspartate und ein Glutamat.
Calmodulin funktioniert
Alle bisher für Calmodulin bekannten Funktionen sind innerhalb einer Gruppe von Aktionen gerahmt, die durch die Erhöhung des zytosolischen Kalziums gefördert werden, die durch den Eingang aus dem extrazellulären Raum oder seinem Ausgang aus den intrazellulären Ablagerungen erzeugt werden: Mitochondrien und endoplasmatisches Retikulum.
Viele der Kalziumaktionen werden durch dieses Ion erfüllt, das direkt auf seine weißen Proteine wirkt, was von vielfältiger Natur und Funktionen sein kann. Einige dieser Proteine können nicht direkt beeinflusst werden, erfordern jedoch, dass Calcium sich dem Calmodulin verbindet und dieser Komplex auf das vom Ion beeinflusste Protein wirkt.
An diesen weißen Proteinen, die abhängig Calcium-Calmodulin sind, und unter ihnen Dutzende von Enzymen wie Proteinen, Proteinphosphase, Nucleotidzyklassen und Phosphodiesterasen; Alle beteiligen an unzähligen physiologischen Funktionen, einschließlich:
- Stoffwechsel
- Partikeltransport
- Viszerale Mobilität
- Substanzsekretion
- Eizellendüngung
- Genetische Expression
- Zellvermehrung
- Die strukturelle Integrität von Zellen
- Interzelluläre Kommunikation usw.
Unter den Calmodulin -abhängigen Proteinen werden zitiert: die leichte Kette von Myosin (MLCK), die Cinase -Phosphorylase und die Ca ++/Calmodulin Cinasas I, II und III.
Somit wird die von den Kalziumsignalen codierten Informationen (Erhöhung oder Abnahme seiner intrazellulären Konzentration) durch diese und andere Calcium Union -Proteine "entschlüsselt", wodurch die Signale zu einer biochemischen Veränderung führen. Mit anderen Worten, Calmodulin ist ein intermediäres Protein in calciumabhängigen Signalprozessen.
Kann Ihnen dienen: Glut 2: Eigenschaften, Struktur, FunktionenWirkmechanismus
Calmodulin ist ein sehr vielseitiges Protein, da seine "Ziel" -Proteine in Form, Sequenz, Größe und Funktion erheblich unterschiedlich sind. Da es sich um ein Protein handelt, das als „Sensor“ von Kalziumionen wirkt.
Seine Wirkungsmechanismen können beispielhaft veranschaulicht werden.
Calmodulin und glatte Muskelkontraktion
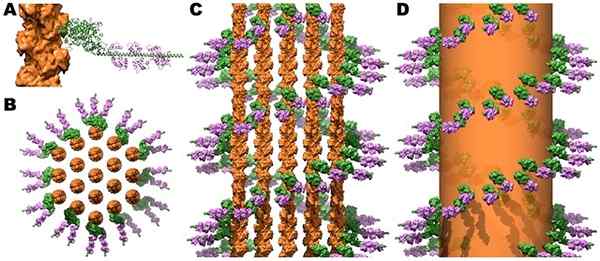 Struktur von Myosinkreuzbrücken und Calmodulin in Mikrovellosen von Aktinstrahlen. Quelle: Jeffrey W. Brown, c. James McKnight [CC von (https: // creativecommons.Org/lizenzen/bis/3.0)]]
Struktur von Myosinkreuzbrücken und Calmodulin in Mikrovellosen von Aktinstrahlen. Quelle: Jeffrey W. Brown, c. James McKnight [CC von (https: // creativecommons.Org/lizenzen/bis/3.0)]] Die Kontraktion der Skelett- und Herzmuskeln wird ausgelöst, wenn die Zunahme des zytosolischen Ca ++ Werte über 10-6 mol/l erreicht und dieses Ion an Troponin C bindet, was Veränderungen zu den osterischen Osteren erfährt, die Tropomiosin beeinflussen. Tropomiosin bewegt sich und enthüllt im Aktin seine Gewerkschaftsstandorte mit Myosin, und leitet sich ab, dass der kontraktile Prozess auslöst.
Im glatten Muskel gibt es kein Troponin C, und die Zunahme von Ca ++ über dem angegebenen Niveau fördert seine Vereinigung mit Calmodulin. Der Ca-Calmodulin-Komplex, der in der leichten Kette von Myosin (MLCK) aktiv ist, was wiederum zu dieser leichten Kette phosphoryliert, aktiviert Myosin und löst den kontraktilen Prozess aus.
Die Zunahme von Ca ++ wird durch den Eingang von außen oder Ausgang aus dem sarkoplasmatischen Retikulum durch Wirkung des durch Phospholipase C freigelassenen Inositol -Tryphosphat (IP3) angegeben. Relaxation tritt auf, wenn Ca ++ durch Transportwirkung aus dem Cytosol entfernt wird und zu seinen Quellstellen zurückkehrt.
Ein wichtiger Unterschied zwischen beiden Arten von Kontraktion besteht darin, dass in den gestreiften Muskeln (Herz und Skelett) das Ca ++ bei der Verbindung seines Proteins, dem Troponin, in den Anschluss an alestherische Veränderungen induziert Myosin Phosphorylierung implizieren.
Sobald die Ca ++ -Akte beendet ist. Dieses neue Enzym ist die Phosphatase der leichten Myosinkette (MLCP), deren Aktivität nicht von Calmodulin abhängt, sondern von anderen Straßen reguliert wird.
Tatsächlich hört der kontraktile glatte Muskelverfahren nicht auf, aber der Grad der Kontraktion wird auf einem Zwischenebene beibehalten Regulierungskontrollen.
Kann Ihnen dienen: PachyneAnpassung in olfaktorischen Sensoren
Das Geruchsempfindungsauslöser, wenn olfaktorische Rezeptoren in der Zilien von Zellen auf der Oberfläche der Riechschleimhaut aktiviert sind.
Diese Rezeptoren sind mit einem heterotrophen G -Protein gekoppelt, das als "Golf" (g olfaktorisches Protein) bekannt ist, das drei Untereinheiten hat: "αolf", "ß" und "γ".
Wenn die olfaktorischen Rezeptoren als Reaktion auf einen Geruch aktiviert werden, werden die Untereinheiten dieses Proteins dissoziiert und das Untereinheit „αolf“ aktiviert das Adenylciclase -Enzym, wodurch Adenosin -cyclisches Monophosphat (AMPC) produziert wird (AMPC) (AMPC).
Der AMPC aktiviert CNG -Typkanäle (durch cyclische Nukleotide aktiviert) für Calcium und Natrium. Diese Ionen gelangen in die Zelle, depolarisieren Sie sie und verursachen den Beginn von Aktionspotentialen, deren Häufigkeit die Intensität des Geruchs bestimmt.
Das Calcium, das eintritt, das dazu neigt, die Zelle zu depolarisieren, hat eine antagonistische Wirkung negativer Rückkopplungsmittel. Dies wird als Sensoranpassung bezeichnet.
Calmodulin in Pflanzen
Pflanzen reagieren auch auf intrazelluläre Konzentrationsunterschiede zu Calciumionen mittels Calmodulin -Protein. In diesen Organismen teilen Calmoduline viele strukturelle und funktionelle Eigenschaften mit ihren Kollegen bei Tieren und Hefen, obwohl sie sich in einigen funktionellen Aspekten unterscheiden.
Zum Beispiel verbindet Calmodulin in Pflanzen kurze Peptidsequenzen in seinen weißen Proteinen und induziert strukturelle Veränderungen, die ihre Aktivitäten als Reaktion auf interne Kalziumvariationen verändern.
Inwieweit Calmodulin in Pflanzen analogen Prozessen kontrolliert, zu denen sie bei Tieren auftreten, ist etwas, das heute noch Gegenstand der Diskussion ist.
Verweise
- Brenner B: Muskulatur, in: Physiologie, 6. ED; R Klinke et al. (Hrsg.). Stuttgart, Georg Thieme Verlag, 2010.
- Ganong WF: Molekulare Grundlage der medizinischen Physiologie, in: in: in: Überprüfung der medizinischen Physiologie, 25. ed. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JI: Einführung in die Endokrinologie, in: Lehrbuch der medizinischen Physiologie, 13. ED, AC Guyton, Je Hall (Hrsg.). Philadelphia, Elsevier Inc., 2016.
- Kaup UB, Müller F: Olfactorischen System, in: Physiologie, 4. Aufl.; P Deetjen et al. (Hrsg.). München, Elsevier GmbH, Urban & Fischer, 2005.
- Korbmacher C, Greger R, Brenner B, Silbernagl S: Die Zelle Als Grundbaustein, in: Physiologie, 6. ED; R Klinke et al. (Hrsg.). Stuttgart, Georg Thieme Verlag, 2010.
- Zielinski, r. UND. (1998). Calmodulin und Calmodulin-bindende Proteine in Pflanzen. Jährliche Überprüfung der Pflanzenbiologie, 49 (1), 697-725.
- « Nicht -Mendelianer -Erbemuster und Beispiele
- Isolierung technischer Mikroorganismen und Bedeutung »

