Wärme -absorbierte Formeln, wie man sie berechnet und Übungen gelöst

- 4298
- 630
- Nick Laurén
Er Hitze absorbiert Es ist definiert als die Energieübertragung zwischen zwei Körpern bei unterschiedlichen Temperaturen. Die mit niedrigere Temperatur absorbiert die Wärme als bei einer höheren Temperatur. In diesem Fall nimmt die thermische Energie der Substanz zu, die Wärme absorbiert.
Dies kann zu einer Erhöhung der Temperatur oder einer Zustandsänderung führen. Wechseln Sie zum Beispiel von fest zu Flüssigkeit, wie z. B. Eis, wenn sie in Kontakt mit Wasser oder Soda bei Raumtemperatur schmilzt.
 Der Metall -Teelöffel absorbiert heiße Kaffeewärme. Quelle: Pixabay.
Der Metall -Teelöffel absorbiert heiße Kaffeewärme. Quelle: Pixabay. Dank der Hitze ist es auch möglich, dass Objekte ihre Dimensionen ändern. Die Wärmeleitdilatation ist ein gutes Beispiel für dieses Phänomen. Wenn die meisten Substanzen erhitzt werden, verzeichnen sie normalerweise eine Zunahme ihrer Abmessungen.
Eine Ausnahme davon ist Wasser. Die gleiche Menge an flüssigem Wasser erhöht sein Volumen, wenn sie unter 4 ºC abgekühlt ist. Darüber hinaus können Temperaturänderungen auch Veränderungen auf der Ebene ihrer Dichte auftreten, was auch bei Wasser auch sehr beobachtet werden kann.
[TOC]
Was ist und Formeln
Bei Energie im Durchgang sind die Einheiten der absorbierten Wärme die Joule. Lange Zeit hatte die Hitze ihre eigenen Einheiten: die Kalorie.
Heute wird diese Einheit verwendet, um den Energiegehalt von Lebensmitteln zu quantifizieren, obwohl in Wirklichkeit eine Lebensmittelkalorie einem Kilokalorie von Hitze entspricht.
Kalorien
Die Kalorie, abgekürzt wie Kalk, Es ist die Wärmemenge, die erforderlich ist, um die Temperatur von 1 Gramm Wasser um 1 º C zu erhöhen.
Im neunzehnten Jahrhundert führte Sir James Prescott Joule (1818 - 1889) ein berühmtes Experiment durch, in dem er es schaffte, die mechanische Arbeit in Wärme umzuwandeln, wobei er die folgende Äquivalenz erhielt:
1 Kalorien = 4.186 Joule
In britischen Einheiten heißt die Wärmeeinheit BTU (Britische Wärmeeinheit), Dies ist definiert als die Wärmemenge, die erforderlich ist, um die Temperatur eines Pfunds Wasser in 1 ºF anzuheben.
Es kann Ihnen dienen: Kalibrierungskurve: Wofür ist es, wie man es macht, BeispieleDie Äquivalenz zwischen Einheiten ist wie folgt:
1 Btu = 252 Kalorien
Das Problem mit diesen alten Einheiten ist, dass die Wärmemenge von der Temperatur abhängt. Das heißt, es ist nicht dasselbe, was erforderlich ist, um von 70 ° C bis 75 ° C zu bestehen als das, das zum Beispiel von 9 ° C bis 10 ° C erforderlich ist, zum Beispiel.
Deshalb betrachtet die Definition gut definierte Intervalle: 14.5 bis 15.5 ° C und 63 bis 64 ° F für Kalorien bzw. BTU.
Was hängt von der Menge der absorbierten Wärme ab?
Die Menge an absorbiertem Wärme, die ein Material sammelt, hängt von mehreren Faktoren ab:
- Masse. Je höher die Masse, desto mehr Wärme kann sie absorbieren können.
- Substanzeigenschaften. Es gibt Substanzen, die abhängig von ihrer molekularen oder atomaren Struktur mehr Wärme absorbieren können als andere.
- Temperatur. Es ist erforderlich, mehr Wärme hinzuzufügen, um eine höhere Temperatur zu erhalten.
Die Menge an Wärme, bezeichnet als als Q, Es ist proportional zu den beschriebenen Faktoren. Daher können Sie als:
Q = m.C.ΔT
Wo M Es ist die Masse des Objekts, C ist eine Konstante genannt spezifische Wärme, eine intrinsische Eigenschaft der Substanz und ΔT Es ist die Temperaturschwankung, die durch Absorption von Wärme erreicht wird.
Δt = tF - Tentweder
Dieser Unterschied hat ein positives Vorzeichen, da bei der Aufnahme von Wärme dies zu erwarten ist TF > Tentweder. Dies geschieht nicht. Wenn das Wasser kocht, bleibt seine Temperatur bei ungefähr 100 ° C konstant, unabhängig davon, wie schnell es kocht.
Wie man es berechnet?
Durch Kontakt mit zwei Objekten bei einer anderen Temperatur erreichen beide nach einer Weile das thermische Gleichgewicht. Die Temperaturen werden also ausgeglichen und die Wärmeübertragung hört auf. Das gleiche passiert, wenn mehr als zwei Objekte in Kontakt sind. Nach einer bestimmten Zeit haben sich jeder auf der gleichen Temperatur.
Es kann Ihnen dienen: Magnetisierung: Orbital- und Spin -Magnetmoment, BeispieleUnter der Annahme, dass Objekte in Kontakt ein geschlossenes System bilden, aus dem Wärme nicht entkommen kann, wird das Prinzip der Energieeinsparung angewendet, sodass dies bestätigt werden kann:
Q absorbiert = - q Verrissen
Dies stellt eine Energiebilanz dar, ähnlich der der Eingänge und Ausgaben einer Person. Deshalb hat die CEDED -Wärme ein negatives Vorzeichen, da für das Objekt, das ergibt. Deshalb:
Δt = tF - Tentweder < 0
Die Gleichung q absorbiert = - q Verrissen Es wird verwendet, wenn zwei Objekte in Kontakt sind.
Die Energiebilanz
Um die Energiebilanz durchzuführen, muss die Objekte unterschieden werden, die Wärme von denen absorbieren, die dann ergeben, dann:
Σ qk= 0
Das heißt, die Summe der Energiegewinne und -verluste in einem geschlossenen System muss gleich 0 sein.
Die spezifische Wärme einer Substanz
Um die Menge der absorbierten Wärme zu berechnen, müssen Sie die spezifische Wärme jeder teilnehmenden Substanz kennenlernen. Dies ist die Wärmemenge, die erforderlich ist, um die Temperatur von 1 g Material um 1 º C anzuheben. Die Einheiten im internationalen System sind: Joule/kg . K.
Es gibt Tabellen mit der spezifischen Wärme zahlreicher Substanzen, die im Allgemeinen unter Verwendung eines Kalorimeters oder ähnlichen Werkzeuge berechnet wurden.
Ein Beispiel für die Berechnung der spezifischen Wärme eines Materials
250 Kalorien sind erforderlich, um die Temperatur eines Metallrings von 20 bis 30 ° C zu erhöhen. Wenn der Ring eine Masse von 90 g hat. Was ist die spezifische Wärmewärme in Si -Einheiten??
Lösung
Die Einheiten werden zuerst konvertiert:
Q = 250 Kalorien = 1046.5 J
m = 90 g = 90 x 10-3 kg
Kann Ihnen dienen: Elastische Schocks: In einer Dimension, besonderen Fällen, Übungen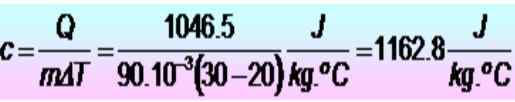
Übung gelöst
Ein Aluminiumbecher enthält 225 g Wasser und einen 40 g Kupfertreuer, alle bei 27 ° C. Eine Probe von 400 g Silber bei einer Anfangstemperatur von 87 ° C wird im Wasser platziert.
Der Agitator wird verwendet, um das Gemisch zu rühren, bis es seine endgültige Gleichgewichtstemperatur von 32 ° C erreicht. Berechnen Sie die Masse des Aluminiumbechers, wenn man bedenkt, dass es keine Wärmeverluste für die Umwelt gibt.
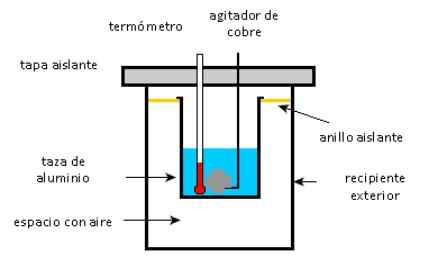 Kalorimeter Schema. Quelle: Solidswiki.
Kalorimeter Schema. Quelle: Solidswiki. Ansatz
Wie oben erwähnt, ist es wichtig, die Objekte zu unterscheiden, die Wärme von denen liefern, die absorbieren:
- Aluminiumbecher, Kupfer- und Wasserstrafe absorbieren Wärme.
- Die Silberprobe liefert Wärme.
Daten
Die spezifischen Wärme jeder Substanz werden geliefert:
- Silber: C = 234 j/kg. ºC
- Kupfer: C = 387 j/kg. ºC
- Aluminium C = 900 J/kg. ºC
- Wasser C = 4186 j/kg. ºC
Die von jeder Substanz absorbierte oder zugeordnete Wärme wird durch Gleichung berechnet:
Q = m.C.λT
Lösung
Silber
Q Verrissen = 400 x 10 -3 . 234 x (32 - 87) J = -5148 J
Kupfer Agitator
Q absorbiert = 40 x 10 -3 . 387 x (32 - 27) J = 77.4 J
Wasser
Q absorbiert = 225 x 10 -3 . 4186 x (32 - 27) J = 4709.25 J
Aluminiumbecher
Q absorbiert = m Aluminium . 900 x (32 - 27) J = 4500 .M Aluminium
Nutzung von:
Σ qk= 0
77.4 + 4709.25 + 4500 .M Aluminium = - (-5148)
Schließlich wird die Aluminiummasse gelöscht:
M Aluminium = 0.0803 kg = 80.3 g
Verweise
- Giancoli, d. 2006. Physik: Prinzipien mit Anwendungen. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, l. 2007. Physik: Ein Blick auf die Welt. 6ta Abgekürzte Ausgabe. Cengage Lernen. 156 - 164.
- Rex, a. 2011. Grundlagen der Physik. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Universitätsphysik mit moderner Physik. 14th. Band 1. 556 - 553.
- Serway, r., Vulle, c. 2011. Grundlagen der Physik. 9n / A Cengage Lernen. 362 - 374
- « Adeninstruktur, Biosynthese, Funktionen
- Makromoleküle Eigenschaften, Typen, Funktionen und Beispiele »

