CEPED -Wärmeformeln, wie man sie berechnet und Übungen gelöst

- 2156
- 162
- Said Ganzmann
Er Hitze abgeholzt Es ist die Energieübertragung zwischen zwei Körpern bei unterschiedlichen Temperaturen. Die eine höhere Temperatur verleiht dem, dessen Temperatur niedriger ist. Egal, ob ein Körper Wärme ergibt oder absorbiert, seine Temperatur oder seine körperliche Verfassung kann je nach Masse und Eigenschaften des Materials variieren, dessen Material erstellt wird.
Ein gutes Beispiel ist in einer Tasse dampfendem Kaffee. Der Löffel Metall, mit dem Zucker gerührt wird. Wenn es in der Tasse genügend Zeit bleibt, enden Kaffee und Metalltezoon. Eine gewisse Wärme wird an die Umgebung übergeben, da das System nicht isoliert ist.
 Der Kaffee und der Teelöffel werden eine Weile im thermischen Gleichgewicht. Quelle: Pixabay.
Der Kaffee und der Teelöffel werden eine Weile im thermischen Gleichgewicht. Quelle: Pixabay. Wenn die Temperaturen abgestimmt sind, die Thermalgleichgewicht.
Wenn der gleiche Test mit einem Kunststoff -Teelöffel durchgeführt würde, würde es sicherlich feststellen.
Dies liegt daran, dass das Metall die Hitze besser leitet als das Kunststoff. Auf der anderen Seite verleiht Kaffee sicher mit einer anderen Geschwindigkeit Hitze als heiße Schokolade oder ein anderes Getränk. Dann hängt die von jedem Objekt zugewiesene oder absorbierte Wärme davon ab, welches Material oder die Substanz hergestellt wird.
[TOC]
Was ist und Formeln
Wärme bezieht sich aufgrund der Temperaturdifferenz immer auf den Fluss oder den Transit der Energie zwischen einem Objekt und einem anderen.
Aus diesem Grund wird die Rede von Wärme zugewiesen oder absorbiert Wärme, da durch Hinzufügen oder Extrahieren von Wärme oder Energie in irgendeiner Weise möglich ist, die Temperatur eines Elements zu modifizieren.
Es wird normalerweise die Wärmemenge bezeichnet, die das heißeste Objekt ergibt. Dieser Wert ist proportional zur Masse des Objekts. Ein Körper mit großer Masse kann mehr Hitze aufgeben als ein anderer weniger Masse.
Kann Ihnen dienen: Millikan Experiment: Verfahren, Erklärung, WichtigkeitDie Temperaturdifferenz Δt
Ein weiterer wichtiger Faktor bei der Berechnung der zugewiesenen Wärme ist die Temperaturdifferenz, die das Objekt, das die Wärme erlebt. Es wird als Δ bezeichnetT Und es wird so berechnet:
Δt = tF - Tentweder
Schließlich hängt die Menge der zugewiesenen Wärme auch von der Art und den Eigenschaften des Objekts ab, die quantitativ in einer Konstante genannt werden Spezifische Wärmewärme, bezeichnet als C.
Der Ausdruck für die zugewiesene Wärme lautet also wie folgt:
QVerrissen = - m.C.ΔT
Die Ausbeute wird mit einem negativen Vorzeichen symbolisiert.
Die spezifische Wärme und Wärmekapazität einer Substanz
Die spezifische Wärme ist die Wärmemenge, die erforderlich ist, um die Temperatur von 1 g Substanz um 1 ° C zu erhöhen. Es ist eine intrinsische Eigenschaft des Materials. Die Einheiten im internationalen System sind: Joule/kg . K (Joule zwischen Kilogramm x Temperatur in Grad Kelvin).
Die Wärmekapazität C ist ein verknüpftes, aber etwas anderes Konzept, da die Masse des Objekts interveniert. Wärmekapazität wird wie folgt definiert:
C = MC
Seine Einheiten in s.Yo. Sie sind Joule/K. Damit die CEDED -Wärme auch äquivalent ausgedrückt werden kann wie:
Q = -C. ΔT
Wie man es berechnet?
Um die von einem Objekt zugewiesene Wärme zu berechnen, muss Folgendes wissen:
- Die spezifische Wärme der Substanz, die die Wärme verleiht.
- Die Masse der Substanz
- Die endgültige Temperatur zu erhalten
Die spezifischen Wärmewerte für viele Materialien wurden experimentell ermittelt und sind in Tabellen erhältlich.
Kalorimetrie
Wenn dieser Wert nicht bekannt ist, ist es möglich, ihn mit Hilfe eines Thermometers und Wassers in einem thermisch isolierten Behälter zu erhalten: Der Kalorimeter. Ein Schema dieses Geräts ist in der Abbildung dargestellt, die Übung 1 begleitet.
Eine Probe der Substanz ist bei einer bestimmten Wassermenge, die zuvor gemessen wurde. Die Endtemperatur wird gemessen und mit den Werten wird die spezifische Wärme des Materials bestimmt.
Kann Ihnen dienen: Zufallsfehler: Formel und Gleichungen, Berechnung, Beispiele, ÜbungenWenn Sie das Ergebnis mit tabellarischen Werten vergleichen, kann es bekannt sein, welche Substanz es ist. Dieses Verfahren wird genannt Kalorimetrie.
Der Wärmeausgleich wird durch Energieerhaltung durchgeführt:
Q Verrissen + Q absorbiert = 0
Gelöste Übungen
Übung 1
Ein 0 Stück 0.35 kg bei einer Temperatur von 150 ° C in 500 ml Wasser bei einer Temperatur von 25 ° C. Finden:
A) Die endgültige Gleichgewichtstemperatur
b) Wie viel Wärme fließt in diesem Prozess?
Daten
CKupfer = 385 J/kg . ºC
CWasser = 4180 j/kg . ºC
Wasserdichte: 1000 kg/m3
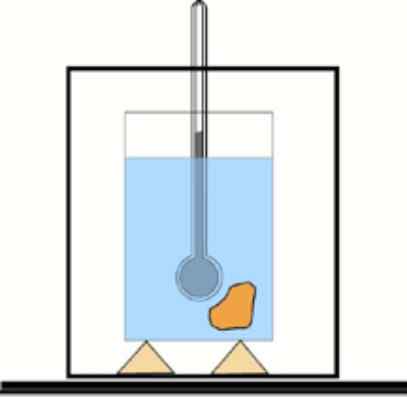 Grundkalorimeterschema: Ein Behälter mit isoliertem Wasser und ein Thermometer zur Messung der Temperaturänderungen. Lfiente: dr. Tilahun Tesfaye [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Grundkalorimeterschema: Ein Behälter mit isoliertem Wasser und ein Thermometer zur Messung der Temperaturänderungen. Lfiente: dr. Tilahun Tesfaye [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Lösung
a) Kupfer verleiht Wärme, während Wasser es absorbiert. Da das System als geschlossen angesehen wird, greift nur Wasser und Probe in die Wärmeausgleich ein:
Q Verrissen = Q absorbiert
Andererseits ist es notwendig, die Masse von 500 ml Wasser zu berechnen:
500 ml = 0.5 l = 0.0005 m3
Mit diesen Daten wird die Masse des Wassers berechnet:
Masse = Dichte x Volumen = 1000 kg/m3 . 0.0005 m3 = 0.5 kg
Die Wärmegleichung wird in jeder Substanz angehoben:
QVerrissen = -mKupfer . CKupfer. ΔT = -0.35 kg . 385 J/kg .ºC . (TF -150 ºC) = -134.75 (tF - 150) J
Qabsorbiert = mWasser . CWasser. ΔT = 0.5 kg . 4186 j/kg . ºC .(TF -25 ºC) = 2093 (tF -25) J
Ausgleich der Ergebnisse, die Sie haben:
2093 (tF - 25) = -134.75 (tF - 150)
Es ist eine lineare Gleichung mit einem Unbekannten, dessen Lösung lautet:
TF = 32.56 ºC
b) Die Menge an Wärme fließt die zugewiesene Wärme oder die absorbierte Wärme:
Q Verrissen = - 134.75 (32.56 - 150) J = 15823 J
Q absorbiert = 2093 (32.56 - 25) J = 15823 J
Übung 2
Ein 100 g Kupferstück wird in einem Ofen auf eine T -Temperatur erhitztentweder Und dann wird es in einen Kupferkalorimeter von 15 g eingeführt, der 200 g Wasser bei 16 º C enthält. Die endgültige Temperatur einmal im Gleichgewicht beträgt 38 º c. Wenn der Kalorimeter und sein Inhalt abgewogen werden, wird festgestellt, dass ich verdunstet ist.2 g Wasser Was war die Anfangstemperatur tentweder?
Kann Ihnen dienen: Wurmloch: Geschichte, Theorie, Typen, FormationDaten: Die latente Wasserdampfwärme ist lv = 2257 kJ/kg
Lösung
Diese Übung unterscheidet sich von der vorherigen, da berücksichtigt werden muss, dass der Kalorimeter auch Wärme absorbiert. Die vom Kupferstück zugewiesene Wärme ist in alle folgenden Folgen investiert:
- Das Wasser aus dem Kalorimeter erhitzen (200 g)
- Erhitzen Sie das Kupfer, dessen Kalorimeter hergestellt wird (150 g)
- Verdampfen 1.2 Gramm Wasser (für eine Phasenänderung benötigen Sie auch Energie).
QVerrissen = -100 X 1 x 10 -3 kg. 385 J/kg . ºC. (38 - tentweder ) ºC = -38.5. (38 - tentweder) J
Q von ihm absorbiert Kalorimeter = Q von Wasser absorbiert + Q Verdampfung + Q von Kupfer absorbiert
0.2 kg .4186 J/kg ºC .(38 - 16 ºC) + 1.2 x 10-3 kg. 2257000 j/kg +0.150 kg .385 J/kg .ºC.(38 - 16 ºC) =
18418.4 +2708.4 + 1270.5 J = 22397.3 j
Deshalb:
-38.5. (38 - tentweder) = 22397.3
Tentweder = 619.7 ºC
Die Wärme, die zum Tragen des 1 erforderlich ist, könnte ebenfalls in Betracht gezogen werden.2 g Wasser bis zu 100 ° C, aber es ist eine ziemlich geringe Menge im Vergleich.
Verweise
- Giancoli, d. 2006. Physik: Prinzipien mit Anwendungen. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, l. 2007. Physik: Ein Blick auf die Welt. 6ta Abgekürzte Ausgabe. Cengage Lernen. 156 - 164.
- Rex, a. 2011. Grundlagen der Physik. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Universitätsphysik mit moderner Physik. 14th. Ed. Band 1. 556 - 553.
- Serway, r., Vulle, c. 2011. Grundlagen der Physik. 9n / A Cengage Lernen.
- « Empfindliches Wärmekonzept, Formeln und Übungen gelöst
- Definition der faktoriellen Rig, Formeln und Übungen »

