Verbrennungswärme

- 4763
- 358
- Ivan Pressler
Was ist die Hitze der Verbrennung??
Er Verbrennungswärme Es ist die Energie freigesetzt, wenn eine bestimmte Menge an Material, normalerweise ein Mol, exotherm mit dem Sauerstoff der Luft reagiert. Es handelt.
Wenn eine Substanz Licht und Wärme verbrennt, Energie, die verwendet werden kann, um an anderen Körpern zu arbeiten. Zum Beispiel ist die erzeugte Wärme in der Lage, große Wasservolumina zu erhitzen, deren Dampf die Umgebung drückt und einige elektrische Erzeuger wirkt. oder einfach weiter erwärmen gedämpfte Lebensmittel.
 Die durch die Verbrennung des Küchengas erzeugte Wärme wird zum Erhitzen der Kesseln und der Nahrung verwendet
Die durch die Verbrennung des Küchengas erzeugte Wärme wird zum Erhitzen der Kesseln und der Nahrung verwendet Die Verbrennungswärme variiert zwischen allen Substanzen, obwohl seine chemische Natur im Wesentlichen gleich ist. Diese Variation entspricht der relativen Stabilität, dh umso instabiler eine Verbindung, desto größer die freigesetzte Energie, dargestellt als -δH. Das negative Symbol bedeutet, dass die Wärme herausfließt.
Unterschiedliche -ΔH -Werte werden verwendet, um die relative Stabilität zwischen verschiedenen Alkaus und ihren Isomeren zu vergleichen. Es ermöglicht es auch stabil zu sein.
Messung
Um die Verbrennungswärme zu messen, wird eine kalorimetrische Pumpe benötigt. Darin reagiert die Substanz mit Sauerstoff durch die Aktivierung eines elektrischen Funkens mit Sauerstoff.
Dann erhitzt die Wärme ein Volumen Wasser, das das Probenfach umgibt und die Temperatur vor und nach der Verbrennung sowie die Masse von Wasser und Kraftstoff misst.
Die freigesetzte Energie entspricht also:
CEH2O·MH2Oder · Δt
WoEH2O Es ist die spezifische Wasserwärme, 4.184 J/G · ºC, MH2Oder die Masse des Wassers und Δt seine Temperaturänderung. Schließlich wird diese Wärme, die in Joule oder Kalorieneinheiten ausgedrückt wird, zwischen der Masse oder den Mol des Kraftstoffs aufgeteilt, die in der kalorimetrischen Pumpe platziert sind.
Kann Ihnen dienen: Was ist das mechanische Äquivalent der Wärme??Metalle kombinieren sich nicht, sondern oxidieren Sie bei unterschiedlichen Geschwindigkeiten je nach Temperatur, bei der sie ausgesetzt sind. Die Wärme, die sie erzeugen, ist verabscheuungswürdig, um genauso gemessen zu werden wie mit Kohlenwasserstoffen und anderen Kraftstoffen. Sie sind daher keine brennbaren Substanzen.
Potenzielle Energien
Während der Verbrennung sind die Links gebrochen, um neue zu bilden, stabiler,. Die Energie, die in allen Molekülverbindungen enthalten ist.
Je größer die potentielle Energie ist, desto instabiler wird das Molekül und daher mehr Wärme freigesetzt, sobald die neuen Verbindungen hergestellt werden.
Um zu wissen, welche genau diese neuen Links sind, sollten die Produkte einer vollständigen Verbrennung berücksichtigt werden: co2 Für Kohlenstoff, h2Oder für Wasserstoff und nicht für2 Für Stickstoff. In Bezug auf Kohlenwasserstoffe erzeugt ihre vollständige Verbrennung stöchiometrische Gemische von co2 und h2ENTWEDER.
Beide Moleküle, CO2 und h2Oder sie haben sehr niedrige potenzielle Energien, weil ihre Verbindungen (o = c = o und h-o-h) im Vergleich zu den Kohlenwasserstoffverbindungen, aus denen sie stammten, sehr stabil sind (C-H und C-C).
Relative Stabilität
Potenzielle Energien sind frei. Ihre Variationen sind jedoch nicht, dh der Unterschied dieser Energien zwischen den Produkten (co2 und h2O) und Reaktanten (Kohlenwasserstoffe).
Aus diesem Grund können Sie diese Variationen oder was gleich ist, und ihre Verbrennung heizt, wie die relative Stabilität zwischen einer Reihe von Kohlenwasserstoffen oder Isomern ist.
Schließt
Die Alkane können linear, verzweigt oder zyklisch sein. Bei linearen Alkanen variiert seine Verbrennungswärme je nach Länge seiner Ketten; Das heißt, es hängt davon ab, wie viele Einheiten CH2 haben. Betrachten Sie das Beispiel von N-Hexan, N-Heptano und N-Oktan:
Es kann Ihnen dienen: Jod: Geschichte, Eigenschaften, Struktur, Erhalten, Risiken, verwendetCH3(CH2)4CH3, -ΔH = 4163 kJ/mol
CH3(CH2)5CH3, -ΔH = 4817 kJ/mol
CH3(CH2)6CH3, -ΔH = 5471 kJ/mol
Sie können sehen, dass seine Verbrennungshitze je nach 654 kJ/mol variieren. Dies bedeutet, dass jeder Cho2 Dies wird der Kette zugesetzt. So die Nonano, ch3(CH2)7CH3, Es wird eine Verbrennungswärme haben, die 6125 kJ/mol (5471 kJ/mol + 654 kJ/mol) entspricht.
Dies ist dasselbe wie zu sagen, dass längere Ketten größere potenzielle Energien haben und daher instabiler sind.
Verbrennte Alkane sind stabiler als linear, und dies wird aus ihren Verbrennungsheizungen abgeleitet. Betrachten Sie nun den Fall von drei Isomeren der Oktan:
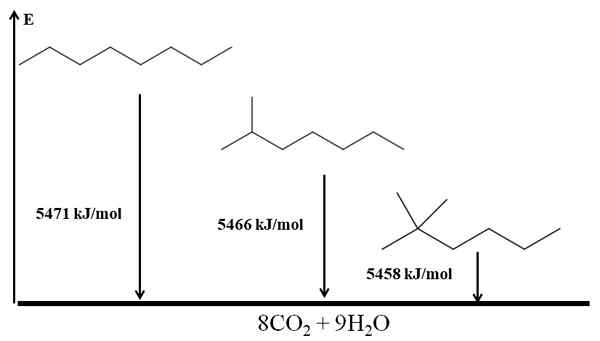 Verbrennung erwärmt sich für drei Oktan -Isomere. Quelle: Gabriel Bolívar über Molview.
Verbrennung erwärmt sich für drei Oktan -Isomere. Quelle: Gabriel Bolívar über Molview. Er N-Octano ist am instabilsten, weil seine Verbrennungswärme die größte ist (5471 kJ/mol). Andererseits die Isomere 2-Methylheptano und 2,2-Dimethylhexan. Der 2,2-Dimethylhexan ist der stabilste, um am stärksten der drei Isomere verzweigt zu sein.
Alkene
Die relative Stabilität von Alkenen kann auch aus ihren Verbrennungsheizungen erhalten werden. Betrachten Sie zum Beispiel vier Butenus -Isomere:
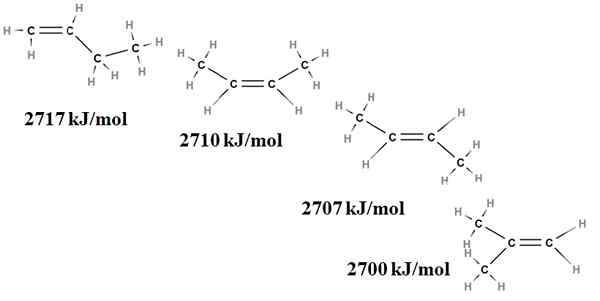 Verbrennung erwärmt sich für Buten -Isomere. Quelle: Gabriel Bolívar über Molview.
Verbrennung erwärmt sich für Buten -Isomere. Quelle: Gabriel Bolívar über Molview. Hier sprechen wir nicht mehr über Auswirkungen, sondern über den Ersatzgrad der Doppelbindung, C = C und ihre Spannungen von Van der Waals; Das heißt, elektronische und sterische Abstoßungen zwischen zwei sperrigen Gruppen auf derselben Seite der Doppelbindung.
Das erste Isomer, 1-Buten, ist am instabilsten, weil seine Doppelbindung weniger ersetzt wird (h2C = c). Dies spiegelt sich in seiner Verbrennungswärme von 2717 kJ/mol wider.
Kann Ihnen dienen: ChlorogensäureRechts ist das cis-2-Buten etwas stabiler, da seine Doppelbindung stärker ersetzt wird. Aber das Trans-2-Buten ist noch mehr, denn selbst wenn es den gleichen Substitutionsgrad hat, Choons3 der Doppelbindung sind in Transpositionen, dh auf verschiedenen Seiten der Doppelbindung. Beachten Sie, dass die Wärme des Trans-2-Buten (2707 kJ/mol) kaum etwas niedriger ist als die des cis-2-Buten (2710 kJ/mol).
Das letzte Isomer, das 2-Methyl-2-Butene, das ebenfalls gleichermaßen ersetzt ist wie die cis und trans 2 Bungeo, ist dennoch das instabilste von allen. Dies liegt daran, dass beide CH3 Sie sind in einem der Kohlenstoffe der Doppelbindung zu finden, weshalb ein Alken mit Cho ist3 Geminale.
Carbonylverbindungen
Neben der Alkos und anderer Kohlenwasserstoffe im Allgemeinen hängen die relative Stabilität der Carbonylverbindungen (Ketone, Aldehyde, Carbonsäuren) auch mit ihren Verbrennungswärmen zusammen.
So sind Minderjährige, je stabilisierter oder weniger reaktiv ihre Gruppen sind, ihre Verbrennungserhitze.
Zum Beispiel die Verbrennungswärme des Butanal, ch3CH2CH2Cho, es ist 2475 kJ/mol. Diese Wärme ist höher als der 2-Butanon, Ch3CH2Coch3, das entspricht 2442 kJ/mol. Daher ist Butanal instabiler als 2-Butanon.
Im 2-Butanon ist das C = O dank der Gruppen ch3CH2 und Ch3; Was mit dem Butan nicht passiert, wo eine der Gruppen kaum ein Atom h ist.
Verweise
- Morrison, r. T. und Boyd, r, n. (1987). Organische Chemie. 5. Ausgabe. Editorial Addison-Wesley Interamerikaner.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. (10. Ausgabe.). Wiley Plus.
- Wikipedia. (2020). Verbrennungswärme. Abgerufen von: in.Wikipedia.Org
- CK-12 Foundation. Verbrennungswärme. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- BBC. (2020). Chemische Energie: Enthalpie der Verbrennung. Abgerufen von: BBC.CO.Vereinigtes Königreich
- Steven a. Hardinger. (2017). Illustriertes Glossar der organischen Chemie: Enthalpie der Verbrennung. Erholt von: Chem.UCLA.Edu

