Wärmeformeln und Einheiten, Eigenschaften, wie wird gemessen, Beispiele

- 3039
- 163
- Frederike Birkemeyer
Er Hitze In der Physik ist es definiert als die Wärmeenergie übertragen vorausgesetzt, dass Objekte oder Substanzen, die bei unterschiedlicher Temperatur sind. Diese Energieübertragung und alle damit verbundenen Prozesse sind das Objekt der Thermodynamik, ein wichtiger Zweig der Physik.
Wärme ist eine der mehreren Formen, die Energie annehmen, und eine der bekanntesten. Deshalb lohnt es sich zu fragen, woher es kommt. Die Antwort liegt in den Atomen und Molekülen, die die Angelegenheit ausmachen. Diese Partikel in Dingen sind nicht statisch. Wir können sie als kleine Konten vorstellen, die von Softfeen vereint sind, die leicht schrumpfen und sich leicht ausdehnen können.
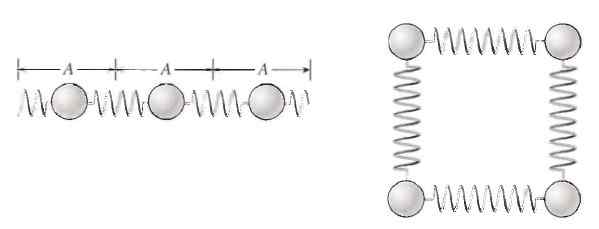 Atome und Moleküle vibrieren in Substanzen, was zu innerer Energie führt. Quelle: p. Tippens. Physik: Konzepte und Anwendungen.
Atome und Moleküle vibrieren in Substanzen, was zu innerer Energie führt. Quelle: p. Tippens. Physik: Konzepte und Anwendungen. Auf diese Weise können Partikel vibrieren und ihre Energie kann leicht auf andere Partikel und auch von einem Körper auf einen anderen übertragen werden.
Die Wärmemenge, die ein Körper absorbiert oder ergibt, hängt von der Art der Substanz, seiner Masse und der Temperaturdifferenz ab. Es wird so berechnet:
Q = m.CUnd .Δt
Wo Q Es ist die Menge an übertragener Wärme, M Es ist die Masse des Objekts, CUnd Es ist die spezifische Wärme der Substanz und Δt = tFinale - TInitial, das heißt, der Temperaturunterschied.
Wie alle Energieformen wird Wärme in gemessen Joule, Im internationalen System (SI). Andere geeignete Einheiten sind: Ergios Im CGS -System, Btu Im britischen System und die Kalorie, ein gemeinsamer Nutzungsbegriff, um den Energiegehalt von Lebensmitteln zu kennen.
[TOC]
Wärmeeigenschaften
 Die Feuerwärme ist Energie bei der Übertragung. Quelle: Pixabay
Die Feuerwärme ist Energie bei der Übertragung. Quelle: Pixabay Es gibt mehrere Schlüsselkonzepte, die berücksichtigt werden müssen:
-Wärme ist ungefähr Energie im Transport. Objekte haben keine Wärme, sie geben sie nur nach den Umständen oder absorbieren sie. Was Objekte tun, sind innere Energie, Unter seiner internen Konfiguration.
Diese interne Energie besteht wiederum aus kinetischer Energie, die mit Schwingungsbewegungen und potentieller Energie verbunden ist, die für die molekulare Konfiguration typisch sind. Gemäß dieser Konfiguration überträgt eine Substanz die Wärme mehr oder leichter, und dies spiegelt sich in ihrer spezifischen Wärme wider CUnd, Der in der Gleichung erwähnte Wert zur Berechnung von q.
-Das zweite wichtige Konzept ist, dass Wärme immer vom heißesten Körper auf den kältesten übertragen wird. Die Erfahrung zeigt, dass die Hitze des heißen Kaffees immer zum Porzellan der Tasse und auf den Teller oder zum Metall des Löffels, mit dem sie umgebaut wird.
-Die Menge der zugewiesenen oder absorbierten Wärme hängt von der Masse des betreffenden Körpers ab. Fügen Sie einer Probe mit X -Teig die gleiche Menge an Kalorien oder Joule hinzu, die nicht zu einem anderen erwärmt wird, dessen Masse 2x ist.
Kann Ihnen dienen: Elektromagnetische Wellen: Maxwell -Theorie, Typen, MerkmaleDer Grund? Es gibt mehr Partikel in der größten Probe, und jeder würde durchschnittlich nur die Hälfte der Energie erhalten als die kleinste Probe.
Wärmeausgleich und Energieeinsparung
Die Erfahrung zeigt uns, dass die Temperatur von beiden gleichzeitig die gleiche Zeit ist, wenn wir zwei Objekte in unterschiedliche Temperaturen setzen. Dann kann bestätigt werden, dass Objekte oder Systeme, wie sie auch genannt werden können, in sind Thermalgleichgewicht.
Auf der anderen Seite wird der Nachdenken darüber nachgedacht, wie die innere Energie eines isolierten Systems erhöht werden kann. Es wird der Schluss gezogen, dass es zwei mögliche Mechanismen gibt:
i) Heizen Sie es, das heißt, Energie aus einem anderen System zu übertragen.
i) Machen Sie eine mechanische Arbeit an ihm.
Unter Berücksichtigung der Energie erhalten bleibt:
Jede Erhöhung der inneren Energie des Systems entspricht der Wärmemenge, die mehr die darauf geleistete Arbeit erhöht.
Im Rahmen der Thermodynamik ist dieses Naturschutzprinzip bekannt Erstes Gesetz der Thermodynamik. Wir sagen, dass das System isoliert werden muss, ansonsten sollten andere Ein- oder Energieausgaben im Gleichgewicht berücksichtigt werden.
Wie wird Wärme gemessen??
Die Wärme wird gemäß dem Effekt gemessen, den es erzeugt. Daher ist es das Berührungssinn, der schnell darüber informiert, wie heiß oder kalt ein Getränk, eine Mahlzeit oder ein Objekt sind. Da das Geben oder Absorptieren von Wärme zu Temperaturänderungen führt, hat die Messung dieser eine Vorstellung davon, wie viel Wärme es übertragen wurde.
Das zur Messung der Temperatur verwendete Instrument ist das Thermometer, ein Gerät, das mit einer abgestuften Skala zur Durchführung des Messgeräts versehen ist. Am bekanntesten ist das Quecksilberthermometer, das aus einer feinen Quecksilberkapillare besteht, die sich beim Erhitzen ausdehnt.
 Ein Thermometer mit Abschluss in Skalen in Celsius und Fahrenheit. Quelle: Pixabay.
Ein Thermometer mit Abschluss in Skalen in Celsius und Fahrenheit. Quelle: Pixabay. Dann wird die Kapillare voller Quecksilber in ein Glasrohr mit einer Skala eingeführt und setzt sich mit dem Körper in Kontakt, dessen Temperatur gemessen werden sollte, bis sie das thermische Gleichgewicht erreichen, und die Temperatur von beiden ist gleich.
Was ist erforderlich, um ein Thermometer zu machen?
Zunächst ist es notwendig, eine thermometrische Eigenschaft zu haben, dh eine, die mit der Temperatur variiert.
Zum Beispiel ein Gas oder eine Flüssigkeit wie Quecksilber, die beim Erhitzen ausdehnen, obwohl es auch elektrischen Widerstand dient, der beim Durchqueren eines Stroms Wärme ausgibt. Kurz gesagt, jede thermometrische Eigenschaft, die leicht messbar ist.
Wenn die Temperatur T ist direkt proportional zur thermometrischen Eigenschaft X, Dann können Sie schreiben:
t = kx
Wo k Es ist die Konstante der Verhältnismäßigkeit, die bestimmt wird, wenn zwei geeignete Temperaturen eingestellt sind und die entsprechenden Werte von X. Geeignete Temperaturen bedeuten im Labor leicht zu erhalten.
Kann Ihnen dienen: Schräg parabolischer Schuss: Eigenschaften, Formeln, Gleichungen, BeispieleSobald Paare festgelegt wurden (T1, X1) Und (T2, X2), Das Intervall zwischen ihnen ist in gleiche Teile unterteilt, dies sind die Noten.
Temperaturskalen
Die Auswahl der erforderlichen Temperaturen zum Aufbau einer Temperaturskala wird mit dem Kriterium erstellt, dass sie im Labor leicht zu erhalten sind. Eine der am häufigsten verwendeten Skalen weltweit ist die Celsius-Skala, die vom schwedischen Wissenschaftler Anders Celsius (1701-1744) erstellt wurde.
Die 0 der Celsius -Skala ist die Temperatur, bei der sich Eis und flüssiges Wasser im Gleichgewicht bei 1 Druckatmosphäre befinden, während der obere Stopp ausgewählt wird, wenn flüssiges Wasser und Wasserdampf gleichermaßen im Gleichgewicht und bei 1 Druckatmosphäre sind. Dieses Intervall ist in 100 Grad unterteilt, von denen jeder genannt wird Grad Celsius.
Dies ist nicht der einzige Weg, um eine Skala zu erstellen, geschweige denn. Es gibt andere verschiedene Skalen, wie die Fahrenheitskala, in denen Intervalle mit anderen Werten ausgewählt wurden. Und da ist die Kelvin -Skala, die nur einen niedrigeren Stopp hat: das absolute Null.
Die absolute Null entspricht der Temperatur, bei der jede Bewegung von Partikeln in einer Substanz vollständig aufhört, obwohl sie jedoch ziemlich nahe war, aber noch nicht auf die absolute Null gekühlt wurde.
Beispiele
Alle erleben täglich Wärme, entweder direkt oder indirekt. Zum Beispiel, wenn ein heißes Getränk aufgenommen wird, wenn die Mittagssonne die Motortemperatur eines Autos untersucht, in einem Raum voller Menschen und in unzähligen weiteren Situationen.

Auf der Erde ist Wärme notwendig, um die Prozesse des Lebens aufrechtzuerhalten, sowohl derjenige, der von der Sonne kommt, als auch derjenige, der das Innere des Planeten verlässt.
Ebenso wird das Klima durch Veränderungen der thermischen Energie angetrieben, die in der Atmosphäre auftreten. Die Sonnenwärme erreicht nicht überall gleich, äquatoriale Breiten kommen mehr als die Pole, so.

Auf diese Weise werden Luftströmungen mit unterschiedlichen Geschwindigkeiten festgelegt, die Wolken und Regen transportieren. Andererseits verursacht die abrupte Kollision zwischen heißen und kalten Fronten Phänomene wie Stürme, Tornados und Hurrikane.
Andererseits ist Wärme auf einer engeren Ebene möglicherweise nicht so willkommen wie ein Sonnenuntergang am Strand. Wärme verursacht Betriebsprobleme bei Automotoren und Computerprozessoren.
Kann Ihnen dienen: Watt Law: Was ist, Beispiele, AnwendungenEs führt auch dazu, dass der Strom in Antriebskabeln und Materialien verloren geht, so.
Übungen
- Übung 1
Auf dem Etikett einer Süßigkeiten liest sich 275 Kalorien bei. Wie viel Energie in Joules entspricht dieser Süßigkeiten?
Lösung
Zu Beginn wurde die Kalorie als Hitzeeinheit erwähnt. Lebensmittel enthalten Energie, die normalerweise in diesen Einheiten gemessen wird, aber das Essen von Kalorien sind tatsächlich Kilokalorien.
Die Äquivalenz lautet wie folgt: 1 kcal = 4186 j, und es wird der Schluss gezogen, dass der Genuss:
275 Kilokalorien x 4186 Joule/Kilokalorie = 1.15 106 J.
- Übung 2
100 g werden auf ein Metall bis zu 100 ° C erhitzt und in einem Kalorimeter mit 300 g Wasser bei 20 ° C gelegt. Die vom System erfasste Temperatur ist 21 beträgt 21.44 ° C. Es wird gebeten, die spezifische Wärme des Metalls zu bestimmen, unter der Annahme, dass der Kalorimeter keine Wärme absorbiert.
Lösung
In dieser Situation gibt das Metall Wärme, die wir Q nennen werdenVerrissen Und ein Zeichen (-) wird vor dem Angeben von Verlust eingesetzt:
QVerrissen = mMetall .ECMetall. Δt
Das Wasser des Kalorimeters absorbiert Wärme, die als absorbiert bezeichnet wird:
Qabsorbiert = mWasser .EC Wasser . Δt
Die Energie bleibt erhalten, aus der aus folgt:
QVerrissen = Qabsorbiert
Aus der Aussage können Sie berechnen Δt:
Metall: Δt = tFinale - TInitial= (21.44 - 100) ºC = -78.56 ºC = -78.56 k.
Wasser: δt = tFinale - TInitial= (21.44 - 20) ºC = 1.44 ºC = 1.44 k.
Wichtig: 1 ºC hat die gleiche Größe wie 1 Kelvin. Der Unterschied zwischen beiden Skalen besteht darin, dass die Kelvin -Skala absolut ist (Kelvin -Klassen sind immer positiv).
Die spezifische Wasserwärme bei 20 ° C beträgt 4186 J/kg. K und damit können Sie die absorbierte Wärme bereits berechnen:
Qabsorbiert = mWasser .EC Wasser . ΔT = 300 x 10-3 kg . 4186 j/kg . K . 1.44 k = 1808.35 J.
Zusammenfassend wird die spezifische Metallwärme gelöscht:
EC Metall = Q absorbiert /-M Metall . ΔT Metall = 1808.35 J / -[(100 x 10)-3 kg. (-78.56 K)] = 230.2 J/kg.K
Verweise
- Bauer, w. 2011. Physik für Ingenieurwesen und Wissenschaften. Band 1. McGraw Hill.
- Cuellar, J.ZU. FISCA II: Kompetenzansatz. McGraw Hill.
- Kirkpatrick, l. 2007. Physik: Ein Blick auf die Welt. 6ta Abgekürzte Ausgabe. Cengage Lernen.
- Ritter, r. 2017. Physik für Wissenschaftler und Ingenieurwesen: Ein Strategieansatz. Pearson.
- Tippens, p. 2011. Physik: Konzepte und Anwendungen. 7. Ausgabe. McGraw Hill
- « Vergangene Farbeneigenschaften und Bedeutung
- Natriummetabisulfit (Na2S2O5) Struktur, Eigenschaften, Verwendungsmöglichkeiten, Risiken »

