Latente Hitze
- 1372
- 194
- Luca Holdt
Was ist latente Hitze?
Latente Wärme ist die Wärmemenge, die eine Substanz absorbieren oder abnehmen muss, um den physischen Zustand oder die Phase zu ändern, wodurch die konstante Temperatur während dieses Prozesses aufrechterhalten wird. Die gelieferte oder freigesetzte Wärme zeigt sich nicht, sie "fühlt" wie gewohnt bei Temperaturschwankungen nicht. Daher der Begriff der latenten Hitze.
Das latente Wort stammt aus dem lateinischen Wort "latenns", was versteckt bedeutet, so dass die latente Wärme so verhält, als ob es nicht existiert, wenn die Temperatur konstant ist. Aber es gibt: Was passiert, ist, dass es in der Änderung der Phase oder des körperlichen Zustand.
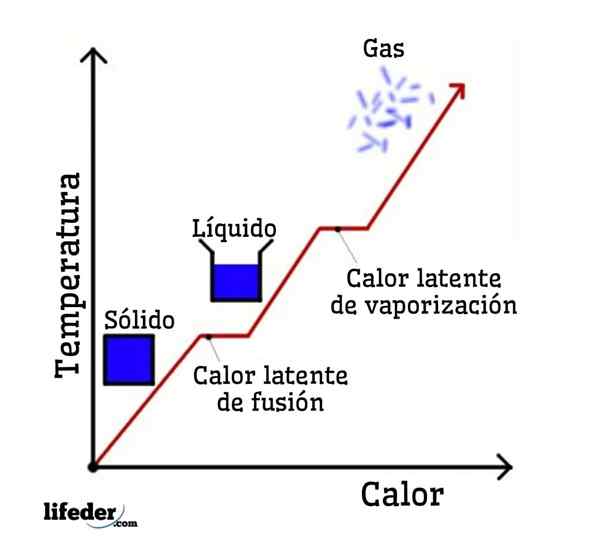
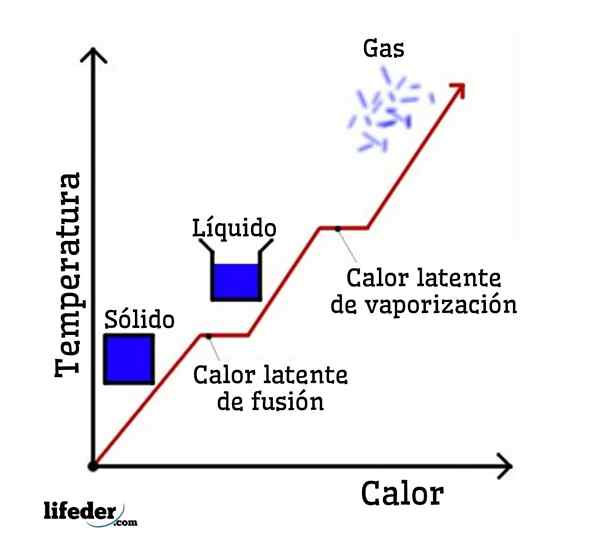
Wenn Wasser als Beispiel genommen wird, sind Phasenänderungen wie folgt: Eis (fest) schmilzt in einem Prozess, der als Fusion bezeichnet wird, zu flüssigem (flüssigem) Wasser; und flüssiges Wasser verdampft wiederum, sich in einen Wasserdampf (Gas) in einen Prozess zu verwandeln, der als Verdampfung bezeichnet wird.
Andererseits wird Wasserdampf in einem Prozess als Kondensation auf flüssiges Wasser abgekühlt. und flüssiges Wasser wird wieder zu Eis in einem Prozess, der als Verfestigung bezeichnet wird.
Jede dieser Phasenveränderungen hat eine latente Wärme, die positiv (Absorption) oder negativ sein kann (Freisetzung).
Latente Schmelzhitze
 Wechseln von fest zu flüssig; Verschmelzung
Wechseln von fest zu flüssig; Verschmelzung Es ist die Wärmemenge, die einer bestimmten Menge fester Substanz zugeführt werden muss, um seinen körperlichen Zustand von fest zu flüssig zu ändern. Während der Fusion gibt es keine Temperaturänderung.
Im Allgemeinen wird diese Wärme in dem normalen Fusionspunkt bestimmt, bei dem der Feststoff unter atmosphärischem Druck zu verschmelzen beginnt. Bei dieser Temperatur gibt es gleichzeitig ein Gleichgewicht oder Vorhandensein gleichzeitig des Festkörperzustands und des flüssigen Zustands.
Kann Ihnen dienen: Kategorische Variable: Merkmale und BeispieleDer Festkörper ist durch das Vorhandensein einer kompakten Struktur aufgrund der Existenz großer chemischer Bindungen gekennzeichnet, die ihm eine strukturelle Steifigkeit verleihen. Für die Umwandlung eines Feststoffs zu Flüssigkeit müssen diese Wechselwirkungen gebrochen werden, so dass sie für diesen Zweck Energie verbraucht (absorbiert).
Ein typisches Beispiel ist, wenn ein Eis konsumiert wird und durch Wasser, Zucker und andere Substanzen gebildet wird. Es ist üblich zu beobachten, dass das Eis, wenn es nicht schnell verzehrt wird, zu schmelzen beginnt, das heißt, schmilzt. Dies geschieht, wenn die Eistemperatur den Eisschmelzpunkt erreicht.
Beispiele
Einige Beispiele für latente Fusionswärme, die in J/G ausgedrückt werden, werden aufgeführt. Das heißt, die Energie, die ein Gramm Feststoff am Schmelzpunkt schmelzen muss:
-Eis 334.0
-380 Aluminium.0
-Schwefel 38.1
-Kupfer 134.0
-Ethanol 104.0
-Quecksilber 11.8
-Gold 64.5
-Silber 80.3
-Führung 24.5
-Wolfram 184
Eis absorbiert sehr Wärme nicht, weil seine Wechselwirkungen stärker sind, sondern weil es in der Lage ist, die Wärme zwischen seinen Kristallen außergewöhnlich abzulösen.
Latente Wärme der Verdampfung
Es ist die Wärmemenge, die eine bestimmte Menge an Substanz absorbiert, um sich vom flüssigen Zustand in den gasförmigen Zustand im normalen Siedepunkt zu bewegen. Das heißt, es ist die Wärme, die die Flüssigkeit absorbiert, wenn sie kocht und wird ohne Temperaturanstieg.
Im Busen der Flüssigkeit können Substanzmoleküle mit der Bildung von Wasserstoffbrücken und für Anziehungskräfte zwischen den Molekülen interagieren. Um eine Substanz vom flüssigen Zustand in den gasförmigen Zustand zu übergeben, müssen Sie diese Kräfte überwinden, sodass Sie Wärme liefern müssen.
Die empfindliche Wärme wird diejenige, die die Flüssigkeit nur absorbiert, um ihre Temperatur zu erhöhen, was von ihrer spezifischen Wärme abhängt. In der Zwischenzeit wird die latente Verdampfungswärme verwendet, um sie direkt in Dampf umzuwandeln, ein Prozess, der am Siedepunkt viel einfacher ist.
Es kann Ihnen dienen: Kalibrierungskurve: Wofür ist es, wie man es macht, BeispieleBeispiele
Im Folgenden finden Sie Beispiele für einige Flüssigkeiten mit ihren jeweiligen latenten Verdampfungswärmen, die erneut in j/g ausgedrückt werden:
-Essigsäure 402
-Aceton 518
-Wasser 2256
-Ethylalkohol 846
-Schwefel 1510
-Benzol 390
-Kohlendioxid 574
-Chlor 293
-Ether 377
-Glycerin 974
-Quecksilber 295
-Sauerstoff 214
Beachten Sie die enorme latente Wärme von flüssigem Wasser: 1 g flüssiges Wasser (ca. 1 ml) muss 2256 J absorbieren, um zu verdampfen. Flüssiges Wasser löst immer noch die Wärme ab, die es erhält, im Vergleich zu Eis viel besser.
Latente Verfestigung Wärme
Es ist die Wärmestand. Auch hier bleibt die Temperatur konstant, bis die Flüssigkeit nicht vollständig verfestigt ist.
Der Verfestigungsprozess ist im Verschmelzungsprozess umgekehrt, so.
Die Moleküle einer Substanz im flüssigen Zustand bewegen sich mit etwas Freiheit aufgrund ihrer Energie, die sie haben. Um sich in die feste Phase zu bewegen, müssen die Moleküle Energie in Form von Wärme freisetzen, was eine größere Wechselwirkung zwischen den Substanzmolekülen ermöglicht.
Die Wechselwirkung zwischen den Molekülen begünstigt die Bildung der chemischen Bindungen der festen Phase. Ein Beispiel dafür tritt auf, wenn flüssiges Wasser zur Eisbildung im Kühlschrank in die Behälter gelegt wird. Der Gefrierschrank extrahiert Wärme aus flüssigem Wasser und wird zu Eis verfestigt.
Beispiele
Im Folgenden finden Sie einige Beispiele für latente Verfestigung von Erwärmungen (in j/g) für einige Flüssigkeiten:
Kann Ihnen dienen: Weißes Loch: Geschichte, Theorie und wie es gebildet wird-Wasser (-334)
-Aluminium (-380)
-Schwefel (-38)
-Kupfer (-134)
-Ethanol (-104)
Latente Kondensationswärme
Es ist die Wärmemenge, die aus einer bestimmten Menge an Substanz freigesetzt oder freigesetzt werden muss, um vom Gaszustand in den flüssigen Zustand zu wechseln. Das kondensierte Gas und die gebildete Flüssigkeit halten während der Kondensation die gleiche Temperatur beibehalten.
Kondensation ist ein Prozess, der der Verdampfung widerspricht. Die latente Kondensationswärme hat den gleichen Wert wie die latente Verdampfungswärme, jedoch mit dem entgegengesetzten Zeichen und am Siedepunkt. Ein Beispiel hierfür ist, wenn es gekocht ist und Dampf in der inneren Gesicht der Töpfe verdichtet wird.
Gasförmige Moleküle bewegen sich frei von der Energie, die sie haben. Daher müssen sie Energie freisetzen, damit die intermolekularen Wechselwirkungen des flüssigen Zustands zwischen den Molekülen der Substanz festgelegt werden können.
In der Natur gibt es viele andere Beispiele für das Phänomen der Wasserkondensation. Wasserdampf steigt in der Atmosphäre auf und kondensiert in den Wolken in Form von Wassertropfen.
Es gibt auch das Vorhandensein von Wassertröpfchen im Glas von Autos, Produkte der Wasserkondensation aufgrund einer Temperaturabnahme am frühen Morgen, was das sogenannte Rocío ausmacht.
Beispiele
Schließlich wird ihre jeweiligen latenten Kondensation noch einmal in j/g: für einige Dämpfe aufgeführt:
-Essigsäure (-402)
-Aceton (-518)
-Wasser (-2256)
-Ethylalkohol (-846)
-Schwefel (-1510)
-Benzol (-390)
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Walter J. Moore. (1963). Physikalische Chemie. In der chemischen Kinetik. Vierte Ausgabe, Longmans.
- Wikipedia. (2020). Latente Hitze. Abgerufen von: in.Wikipedia.Org
- Die Herausgeber von Enyclopaedia Britannica. (2020). Latente Hitze. Erholt von: Britannica.com
- Engineering Toolbox. (2003). Flüssigkeiten: Latente Verdunstungswärme. Abgerufen von: EngineeringToolbox.com
- Lumenlernen. (S.F.). Phasenänderung und ratente Wärme. Erholt von: Kurse.Lumenarning.com

